【题目】生石膏[化学式为CaSO4·2H2O]是一种用途广泛的工业材料和建筑材料。工业上用含SO2的烟气制备生石膏的简要流程图如下:
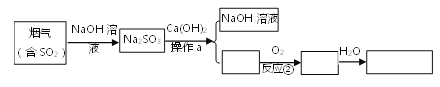
(1)在反应①时,常将NaOH溶液喷成雾状的原因是________。
(2)已知CaSO3不易溶于水,它属于________(填“酸”、“碱”、“盐”或“氧化物”),其中硫元素的化合价为______,反应②的化学方程式是_______。
(3)如果在实验室中进行分离操作a,所需的玻璃仪器有烧杯、玻璃棒和________。
(4)生产流程中生成的______可循环利用,节约成本。
参考答案:
【答案】 增大吸收面积,以加快反应速度 盐 +4 2CaSO3+O2=2CaSO4 漏斗 NaOH溶液
【解析】(1)在反应①时,常将NaOH溶液喷成雾状的原因是增大吸收面积,使反应物接触更充分,以加快反应速度,反应更彻底;(2) 由两种元素组成,且其中一种是氧的化合物叫氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的化合物叫碱。CaSO3属于盐,化合物中元素的化合价代数和为零,钙元素显+2价,氧元素显-2价,CaSO3中硫元素的化合价为+4,反应②的化学方程式是2CaSO3+O2=2CaSO4;(3)分离操作a是将难溶性固体与液体分离,操作是过滤,所需的玻璃仪器有烧杯、玻璃棒和漏斗;(4)生产流程中生成的NaOH溶液在反应物中存在,而且在后续的过程中又产生,可循环利用,节约成本。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图实验装置回答下列问题。
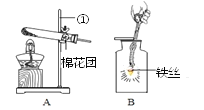
(1)仪器①名称是______。写出用装置A制取氧气的化学方程式_____。该装置能否由于实验室制取二氧化碳?_______。
(2)研究显示:O2的体积分数大于36%时就可使带火星的木条复燃。因此,O2验满时采用使带火星的木条复燃的方法______(填“可靠”或“不可靠”)。为了收集一瓶较纯净的O2,最好采用的方法是______。
(3)将收集到的氧气用来做铁丝燃烧的实验,如图B,此装置存在着缺点,你的改进措施是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下实验操作正确的是
A.
 检查气密性 B.
检查气密性 B.  添加酒精
添加酒精C.
 除去CO中的水蒸气 D.
除去CO中的水蒸气 D.  验证CO2的某些性质
验证CO2的某些性质 -
科目: 来源: 题型:
查看答案和解析>>【题目】某地一辆满载浓硫酸的罐车翻倒,导致溶质质量分数为98%的浓硫酸20t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)溶质质量分数为98%的浓硫酸20t中含H2SO4的质量是________。
(2)计算要完全中和泄漏的98%的浓硫酸20t,理论上需要氢氧化钙的质量为_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)化学与我们的生产、生活息息相关。现有干冰、熟石灰、钛合金三种物质,请选择适当的物质填空。
①可用于人工降雨的是_____;
②可用于制造人造骨的是_____;
③可用于改良酸性土壤的是_____;
(2)天然气是当今人类使用较多的一种化石燃料,其完全燃烧的化学方程式为_____、目前化石燃料日趋枯竭,人类正在积极开发新能源,请你列举一种新能源_____:
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中处处有化学。请按要求回答下列问题:
(1)自来水厂对天然水净化处理得到自来水的过程中,下列操作:①过滤;②吸附;③消毒;④蒸馏,没有用到的是 。(填序号)
(2)用自来水烧水的水壶底部,容易形成水垢,水垢的成分主要是碳酸钙和氢氧化镁,可以用厨房中的一种调味品来清除,这种调味品是 。
(3)为了防止人体缺碘,市售食盐中添加了少量的碘酸钾(KIO3),并在使用说明中强调“不宜高温烹煮”。碘酸钾与氯酸钾性质相似,试写出碘酸钾在加热条件下分解的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列化学实验装置,回答有关问题。
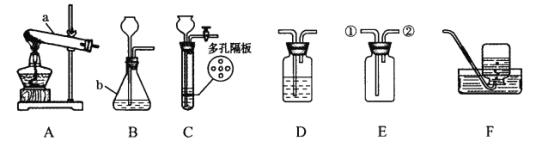
(1)写出图中标有字母的仪器的名称:a___________,b___________。
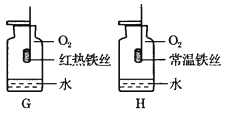
(2)实验室用氯酸钾制取氧气应选择的发生装置是__________ (填代号),可用___________法收集氧气。制得的氧气用来做如右下图所示的实验,发现H中铁丝不燃烧,其原因是__________。写出G中反应的化学方程式__________________。
(3)实验室制取二氧化碳常用的药品是__________,若用装置E收集二氧化碳,则气体应从__________(填“①”或“②”)端进入;若要获得干燥的二氧化碳,可将装置B和装置D用胶皮管连接,并在装置D中盛放__________(填物质名称)试剂。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是_________ 。
相关试题

