【题目】某白色固体可能含有CaCO3、MgCl2、BaCl2、Na2SO4、NaOH中的一种或几种,为了确定其成分,实验过程如下:
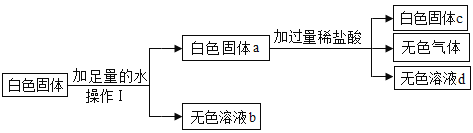
(1)根据题中给出的条件判断,原白色固体中一定含有_____。
(2)为了确定原白色固体中可能存在的物质是否存在,取无色溶液d样品,滴加过量氢氧化钠溶液,若观察到有白色沉淀产生,则原白色固体还含有_____。
(3)若所得的溶液b中只含有一种溶质,对于无色溶液b和白色固体a的用途不合理的是_____。
A除去CaCl2溶液中的稀盐酸:向溶液中加入过量的白色固体a
B鉴别稀盐酸和氢氧化钠溶液:取样,分别滴加无色溶液d
C检验氢氧化钠是否变质:取样,滴加过量的无色溶液d
【答案】CaCO3、BaCl2、Na2SO4 MgCl2和NaOH ABC
【解析】
根据碳酸钙不溶于水,能和稀硝酸反应生成硝酸钙、水和二氧化碳,氯化钡能和硫酸钠反应生成白色沉淀硫酸钡和氯化钠,硫酸钡沉淀不溶于稀硝酸;而氢氧化钠与MgCl2反应氢氧化镁白色沉淀;进行分析。
(1)根据碳酸钙不溶于水,能和稀硝酸反应生成硝酸钙、水和二氧化碳,氯化钡能和硫酸钠反应生成白色沉淀硫酸钡和氯化钠,硫酸钡沉淀不溶于稀硝酸;故根据题中给出的条件判断,原白色固体中一定含有 CaCO3、BaCl2、Na2SO4;
(2)根据氢氧化钠与MgCl2反应生成氢氧化镁白色沉淀,为了确定原白色固体中可能存在的物质是否存在,取无色溶液d样品,滴加过量氢氧化钠溶液,若观察到有白色沉淀产生,这是氯化镁与氢氧化钠反应生成了氢氧化镁白色沉淀,则原白色固体含有MgCl2和NaOH;
(3)A.白色固体中不能排除氯化镁和氢氧化钠的存在。若氯化镁和氢氧化钠同时存在,且恰好完全反应,则白色固体a中就有氢氧化镁存在。除去氯化钙溶液中的盐酸,会增加氯化镁杂质。故不合理;
B.鉴别稀盐酸和氢氧化钠溶液:取样,分别滴加无色溶液b,无色溶液b无酸碱指示剂,无碳酸根,故无现象,故不合理;
C.检验氢氧化钠是否变质,氢氧化钠能和空气中的二氧化碳反应生成碳酸钠,碳酸钠溶液也显碱性:取样,滴加过量的无色溶液b,无色溶液b无酸,故无现象,故不合理。
故选ABC。
故答案为:
(1)CaCO3、BaCl2、Na2SO4;(2)MgCl2和NaOH;(3)ABC。

