【题目】某同学对若干块矿石样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)8g的石灰石样品中含有杂质 克?
(2)如表中m的数值应为 ?
(3)稀盐酸的质量分数是多少?
参考答案:
【答案】(1)1.2;
(2)3;
(3)18.25%.
【解析】
试题分析:(1)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g;
(2)比较第一次和第三次的数据可知第一次中盐酸完全反应,消耗碳酸钙8g﹣5.5g=2.5g,因此第二次中也是消耗2.5g碳酸钙,所以用第一次的剩余固体质量减去第二次消耗的碳酸钙的质量就是第二次剩余固体的质量;
(3)根据第一次加入盐酸生成二氧化碳的质量,依据化学方程式计算盐酸的质量分数.
解:(1)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g;
(2)m=5.5g﹣(8g﹣5.5g)=3g;
(3)设盐酸的溶质质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
8g﹣2.5g x×10g
![]() =
=![]()
x=0.1825
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质世界充满了变化。下列变化属于物理变化的是
A.光合作用 B.钢铁生锈 C.酸雨侵蚀 D.冰山融化
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列生活用品的主要材质属于有机合成材料的是
A.羊毛围巾 B.塑料袋 C.玻璃杯 D.木质桌椅
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气.(样品中其他成分不与稀硫酸反应,氮气不参与任何反应)
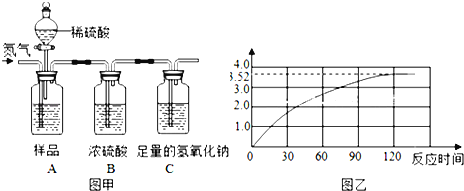
(1)实验前,先往A装置通入一会儿氮气的目的是 .
A、避免容器中的空气对实验干扰
B、检验装置的气密性
C、将反应产生的CO2气体全部赶到C装置中
(2)纯碱样品与稀硫酸充分反应后,产生的CO2气体的质量是 克.
(3)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(Na2CO3+H2SO4═Na2SO4+H2O+CO2↑)
(4)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的性质决定用途,下列说法不正确的是
A.食盐可以配制生理盐水 B.干冰可以用于人工降雨
C.碳酸氢钠可以治疗胃酸过多 D.浓硫酸可以作食品干燥剂
-
科目: 来源: 题型:
查看答案和解析>>【题目】某花圃所种的花卉缺乏氮元素和钾元素,如果只施用一种化肥,则应施用的是
A.K2CO3 B.KNO3 C.CO(NH2)2 D.Ca(H2PO4)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是同学们利用大可乐瓶设计的储气装置(铁架台未画出),以下说法不正确的是
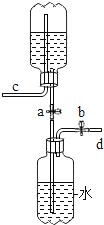
A.打开止水夹a、b.气体从d管倒入储存在下面的瓶子里,水被压入上瓶
B.取用气体时,可通过控制止水夹a、b,靠水的重力方便地将气体排出
C.气体被储存在装置中,c导管也必须安装止水夹
D.该装置也可用于实验室制取二氧化碳的发生装置
相关试题

