【题目】如图是小忻同学设计的一套实验室制备纯净、干燥的CO2和验证CO2能与NaOH反应的装置。
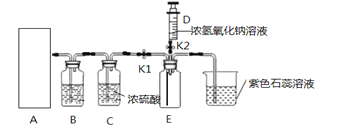
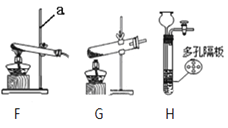
(1)写出仪器a的名称:______________。
(2)在实验室中,为制得二氧化碳,应选择装置______填在A处。
(3)为获得纯净的二氧化碳,装置B中应放_____,装置C中浓硫酸的作用是___________。
a.NaOH溶液 b.澄清石灰水 c.饱和的NaHCO3溶液 d.浓硫酸
(4)当装置E中收集满CO2时,关闭止水夹K1,打开止水夹K2,把注射器D中5mL浓NaOH溶液压入装置E中,发生反应的化学方程式为_______________,观察到的现象是______________。小平同学认为要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的_______,再做一次实验。
(5)小红认为,我们还可以采用检验生成物的方法,确认CO2与NaOH反应了。于是,小玲同学取少量E中溶液于烧杯中,再向溶液中滴加几滴稀盐酸,未发现有气泡产生。据此现象小玲认为CO2与NaOH没有反应。你认为该结论是否正确,并说明理由。__________________。
(6)为了进一步得出结论,几位同学结合所学知识分工合作,集思广益,设计了下列实验进行验证。请将下表补充完整。
实验步骤 | 实验现象 |
①取E中溶液,滴加过量CaCl2溶液 | _____________________________ |
②对①进行过滤,向滤液中滴加_________ | 溶液变红 |
【结论】CO2与NaOH能反应,且反应后的溶液中还有NaOH。
【反思评价】
(1)在实验步骤①中为什么要加入过量的CaCl2溶液?_____________________________。
(2)小玲同学认为在实验步骤①中可以用Ca(OH)2 溶液代替CaCl2证明这一瓶中是否含有NaOH,你认为呢?并说明理由______________________________________________。
参考答案:
【答案】 铁架台 H C 干燥气体 2NaOH+CO2=Na2CO3+H2O 烧杯中的紫色石蕊溶液倒吸入E中,溶液变蓝 水 不正确,少量的盐酸先跟氢氧化钠反应 有浑浊产生 酚酞 碳酸钠溶液液显碱性,影响下一步氢氧化钠的检验 不可以,氢氧化钙与碳酸钠反应也生成氢氧化钠,影响下一步氢氧化钠的检验
【解析】(1)根据常见的仪器解答;(2)根据反应物的状态和反应条件解答;(3)根据二氧化碳气体中可能混有氯化氢气体,用饱和碳酸氢钠溶液吸收氯化氢气体及浓硫酸有吸水性解答;(4)根据氢氧化钠与二氧化碳反应生成碳酸钠和水;反应使气体减少导致装置内压强降低及氢氧化钠溶液显碱性使紫色石蕊溶液变蓝解答;根据对比实验法分析解答;(5)根据少量盐酸可能先与氢氧化钠溶液反应解答;(6)根据碳酸钠溶液与氯化钙溶液反应生成碳酸钙白色沉淀解答;根据氢氧化钠溶液显碱性,能使无色酚酞溶液变红解答;【反思评价】(1)根据碳酸钠溶液液显碱性,加入过量氯化钙溶液的目的是将碳酸钠溶液反应完,避免影响下一步氢氧化钠的检验解答;(2)根据氢氧化钙与碳酸钠反应也生成氢氧化钠,影响下一步氢氧化钠的检验解答。(1)仪器a的名称为铁架台;(2)在实验室中,为制得二氧化碳,通常选择大理石与稀盐酸反应,反应物的状态是固体和液体反应且反应不需要加热。故应选择装置H填在A处;(3) 二氧化碳气体中可能混有氯化氢气体,可用饱和碳酸氢钠溶液吸收氯化氢气体。为获得纯净的二氧化碳,故装置B中应放饱和的NaHCO3溶液,故选C;浓硫酸有吸水性,故装置C中浓硫酸的作用是干燥气体;(4) 氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;反应使气体减少导致装置内压强降低,故观察到的现象是烧杯中的紫色石蕊溶液倒吸入E中,又氢氧化钠溶液显碱性,故溶液变蓝;要证明CO2与NaOH确实反应,还应把注射器NaOH溶液换成等体积的水,再做一次实验;(5)不准确;理由是少量的盐酸先跟氢氧化钠反应;(6) ①碳酸钠溶液与氯化钙溶液反应生成碳酸钙白色沉淀,故实验现象为有浑浊产生;②对①进行过滤,向滤液中滴加酚酞溶液,溶液变红;【反思评价】(1) 碳酸钠溶液液显碱性,加入过量氯化钙溶液的目的是将碳酸钠溶液反应完,避免影响下一步氢氧化钠的检验;(2) 不可以,氢氧化钙与碳酸钠反应也生成氢氧化钠,影响下一步氢氧化钠的检验。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图:把气球中的镁粉加入到盛有稀盐酸的锥形瓶中,气球发生变化(实验装置的气密性良好)。下列关于本实验的说法中错误的是
A. 本实验能说明镁与稀盐酸反应时,有气体放出
B. 本实验能说明与稀盐酸反应时,镁粉比镁条更快
C. 本实验能说明镁与稀盐酸反应有热量放出
D. 本实验能说明温度降低时,分子间的间隔变小
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明用木炭粉还原氧化铜来制取铜,反应化学方程式为:______.
他根据碳的化学性质分析,认为该实验中可能会有一氧化碳产生.
【查阅资料】一氧化碳气体能使湿润的黄色氯化钯试纸变蓝色.
【设计实验】小明设计了下图所示的实验装置,并进行实验验证:
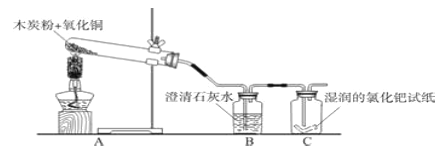
(1)A装置中酒精灯加网罩的目的是_______.
(2)刚用酒精灯给试管A加热时,B装置中就立刻产生气泡,但液体并没有浑浊的现象出现,原因是______.
(3)C中湿润黄色氯化钯试纸变蓝,说明有_____气体生成,证明小明的判断是正确的.你觉得实验产生该气体的原因可能是(写一条):______.
(4)设计装置时还要考虑环保因素,因此,要在装置C右侧导管口添加____装置.
(5)当反应结束后,小明发现一个问题:若先停止加热,______而导致试管炸裂,但若先去除B装置,则会导致________.请你帮助他设计一个实验操作,将试管中还原出的铜倒出:_________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学的核心是研究,科学课程通过科学探究的方式,让我们亲历科学活动,体现科学的发现过程和方法。
(Ⅰ)已知:二氧化碳气体既不溶于饱和NaHCO3溶液也不与NaHCO3反应; NaHCO3 + HCl == NaCl + H2O + CO2↑。某学生欲用浓盐酸与大理石反应制取干燥纯净的二氧化碳气体,实验室提供了下列装置和药品。请回答相关问题:
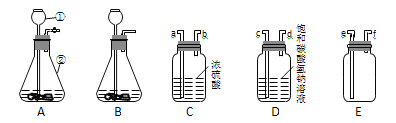
(1)仪器①的名称是__________________。
(2)实验室制取二氧化碳气体的反应原理是___________________(用化学方程式表示)。
(3)装置A、B都可作发生装置,其中可控制反应进行的是________(填装置序号)。
(4)两个净化装置相连接时,其仪器接口顺序应为______接______(填接口序号)。
(5)若用装置E收集二氧化碳气体,则气体应从______(填接口序号)进入。
(Ⅱ)下面是初三某班学生探究铁生锈实验不断完善优化的过程。

(1)优化实验时将Ⅰ中自来水换为蒸馏水目的是_____________________________。
(2)优化实验时增加Ⅳ是为证明铁生锈与空气中的_____________(填化学式)有关。
(3)实验Ⅴ在软塑料瓶中完成的,一周后可观察到铁钉生锈,_____________,同时铁钉靠近水边附近部分锈蚀得厉害。由此可知:铁生锈实际是铁与_______________(填化学式)共同作用的结果。
(4)实验Ⅵ还可用来完成______________________(填实验名称)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】老师为同学们提供了如图所示的实验装置:
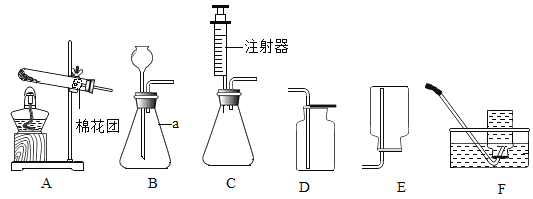
(1)写出a中仪器名称: _______________
(2)若要收集一瓶氧气,供“铁在氧气中燃烧”实验使用,最好选择的气体收集装置是F,理由是①_______,② ___________________ .
(3)实验室制取二氧化碳发生装置可选用装置B或装置C,装置C与装置B相比,装置C优点是______.实验室制取二氧化碳的化学方程式为 _______________ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明同学对探究分子性质的实验(图1)进行了改进,如图2所示,在T形三通管的粗玻璃管里,固定一根湿润的酚酞纱布条。请回答实验中的有关问题。

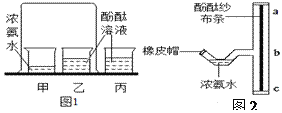
(1)图2实验中用____(填仪器名称)吸取少许浓氨水,将其滴入T形三通管的细弯管处,然后用橡皮帽封闭管口。一会儿,观察到___(填“ba”或“bc”)段纱布条变成红色。
(2)图1丙装置的作用是_____________。 图1和图2的实验均能证明分子______。与图1实验相比,改进后图2实验的优点是_____________________。
(3)若将图2中装有浓氨水的细弯管处浸入冰水中,可观察到纱布条变红的速率变____(填“快”或“慢”),请从微观角度进行解释:_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合图回答问题
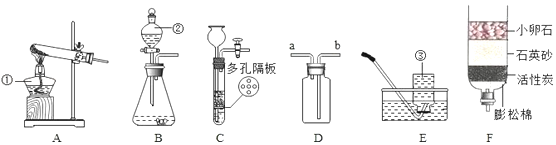
(1)仪器名称:①_____;②_____。
(2)用氯酸钾和二氧化锰制氧气,可选用装置_____(选填序号)和 E 组合,化学方程式 为_____,二氧化锰的作用是_____。
(3)实验室可用装置B或C制 H2,C 装置相对于B的优点有_____,用D装置收集 H2,气体应从_____(选填“a”或“b”)端通入。
(4)F 为简易净水装置,相当于化学实验中的_____装置。向该装置处理过的水中,加入少量肥皂水振荡,产生较多浮渣,说明是水_____(填“硬”或“软”),若要得到纯水,还需 要进行_____(填操作名称)。
相关试题

