【题目】为了测定石灰石中碳酸钙的质量分数,某兴趣小组的同学称取石灰石样品12.5g,高温煅烧至质量不再改变,称得剩余固体质量为8.1g(假设杂质不参加反应)试计算:
(1)生成二氧化碳质量是____g。
(2)石灰石样品中碳酸钙的质量分数是多少_________?(写出计算过程)
参考答案:
【答案】 4.4g 80%
【解析】(1)据质量守恒定律可知反应前后物质的总质量不变,所以生成二氧化碳质量为:12.5g-8.1g =4.4g;
(2)解:设生成4.4g二氧化碳需要碳酸钙的质量为X
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
X 4.4g
![]() X==10g
X==10g
石灰石样品中碳酸钙的质量分数是10g÷12.5g×100%=80%
答、石灰石样品中碳酸钙的质量分数是80%
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙两种固体物质的溶解度曲线.

(1)t1℃时,甲的溶解度____乙的溶解度(选填“大于”“等于”或“小于”);
(2)要使接近饱和的甲溶液变为饱和溶液,可采取的方法是_________________(只填一种);
(3)甲、乙各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌,在t3℃时所得乙溶液为______溶液(选填“饱和”或“不饱和”);若将温度都降低到t2℃,甲溶液中溶质的质量分数______乙溶液中溶质的质量分数(选填“大于”“等于”或“小于”).
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣小组的同学设计了如下实验装置进行实验,按要求填空。
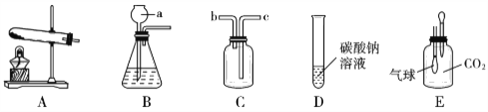
①仪器a的名称____;实验室制取CO2的发生装置是_________(填装置编号);用C装置收集CO2时,气体应从C装置的______端进入(填“b”或“c”)。
②实验室用装置B制取氧气的化学方程式为_______。
③向D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈______性(填“酸”、“碱”或“中”)。
④用E装置探究CO2能否与碳酸钠溶液反应,小组同学做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起。得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明在市场看到,卖鱼老板将一勺白色粉末加入水中,水中奄奄一息的鱼很快张开嘴,活蹦乱跳起来,小明对这种“白色粉末”很感兴趣,与小刚进行了相关探究.
(查阅资料)这种“白色粉末”的主要成分是过碳酸钠(化学式为Na2CO4),常温下,过碳酸钠与水反应生成氧气.
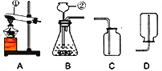
(实验1)小明进行过碳酸钠与水的反应并收集产生的气体,应选用如图所示装置中的__(选填序号),经检验该气体是氧气,检验方法是____________________。
(提出问题)过碳酸钠与水反应后得到的溶液M中溶质的成分是什么?
(作出猜想)根据过碳酸钠与水的组成作出三种猜想.
猜想一:Na2CO3;猜想二:NaOH;猜想三:Na2CO3和NaOH.
(实验2)小刚取溶液M,滴加稀HCl,观察到____________,证明溶液中一定含有Na2CO3,从而否定了猜想二.Na2CO3与稀HCl反应的化学方程式为________________.
(实验3)为进一步确定溶液M中是否含有NaOH,他们向溶质M中滴加CaCl2溶液至不再产生沉淀为止,取上层溶液,加入_______________,无明显现象,证明溶液中无NaOH溶液,猜想一正确.该实验中用CaCl2溶液而不用饱和石灰水,原因是: _________________,加入CaCl2溶液发生的化学方程式________
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是
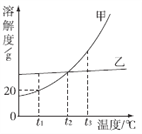
A. t1 ℃时,60 g甲的饱和溶液中溶解了10 g的甲
B. 将t2 ℃甲、乙两种物质的饱和溶液升温至t3 ℃(溶剂的量不变),两种溶液中溶质的质量分数相等
C. t2 ℃时,要使接近饱和的乙溶液达到饱和状态,可蒸发溶剂
D. t2 ℃甲、乙两种物质的饱和溶液中所含溶质的质量相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像不能正确反映其对应变化关系的是
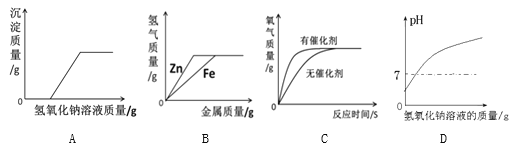
A.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
B.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
C.用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气
D.一定质量稀盐酸中逐滴加入氢氧化钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.请你根据所学知识,从A.干冰 B.硝酸钾 C.金刚石 D.碳酸氢钠E.甲烷五种物质中选择恰当物质的序号填空。
(1)农业上可用作复合肥的是_____;(2)可用于人工降雨的是______
(3)焙制糕点所用的发酵粉主要成分之一________;(4)可做玻璃刀的是_________
(5)天然气的主要成分_______。
Ⅱ.用化学用语填空:
(1)标出二氧化硫中硫元素的化合价_________;(2)2个铵根离子_______;
相关试题

