【题目】取15.0g赤铁矿样品(杂质不溶于水,且不与酸反应)于烧杯中,逐渐加入稀盐酸充分反应。所加盐酸的质量与烧杯中剩余固体的质量的关系如下图所示。
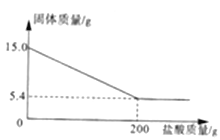
求:(1)该样品中氧化铁的质量为___________g;
(2)稀盐酸中溶质的质量分数为___________?(精确到0.01%,请写出计算过程)
参考答案:
【答案】 9.6 6.57%
【解析】由图中信息知,杂质不溶于水,且不与酸反应,杂质的质量是5.4g。(1)该样品中氧化铁的质量为15.0g-5.4g=9.6g。
(2)解∶设稀盐酸中溶质的质量分数为x
Fe2O3+ 6HCl=2FeCl3 + 3H2O
160 219
9.6g 200g×x
![]() =
=![]() ,x=6.579%。
,x=6.579%。
答∶(1)该样品中氧化铁的质量为9.6g。(2)稀盐酸中溶质的质量分数为6.57%。
点睛∶正确书写化学方程式,并根据化学方程式进行简单的计算是顺利完成本题的重要保证。
-
科目: 来源: 题型:
查看答案和解析>>【题目】汽车尾气催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如图所示。请回答下列问题:
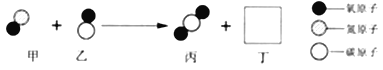
(1)化学反应前后:物质总质量是否发生改变? _____ (选镇“是”或“否”);种类发生改变的微粒是_____ ( 选填“分子”或“原子”)。
(2)丙微粒中碳元素的化合价为___________。
(3)已知丁是一种单质,则丁是_________ ( 写化学式)。
(4)该反应的化学方程式为____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列装置图,请回答问题:
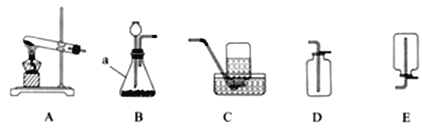
(1)写出图中标号为a的仪器名称__________。
(2)实验室用氯酸钾制取氧气,化学方程式为______________。
(3)用C装置收集氧气,当气泡_________时开始收集。
(4)实验室制取二氧化碳应选择的收果装置是_____(填字母序号)。
(5)用B装置制气体时,长颈漏斗的下端管口要______,以防止生成的气体逸出。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组用铝箔制备A12O3及明矾大晶体,具体流程如下:
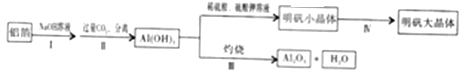
已知:明矾在水中的溶解度随着温度的升高而增大,请回答下列问题:
(1)步骤II中发生反应的化学方程式为:NaAlO2+CO2+2H2O= Al(OH)3↓+X(方程式已 配平)。X的化学式为_____________。
(2)步骤III中发生的反应,其基本反应类型为__________。
(3)写出Al(OH)3与硫酸反应的化学方程式____________。
(4)在培养明矾大晶体的过程中,其操作的先后顺序为__________。
A. 自然冷却至室温
B. 选规则明矾小晶体,并用一根细线悬挂在溶液中央
C. 配制45℃的明矾饱和溶液
(5)写出明矾的一种用途__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某粒子(原子或离子)的结构示意图为
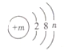 ,请回答下列问题:
,请回答下列问题:(1)若n=3,则m=______;
(2)若该粒子为电中性,则n的最大值为____;
(3)若m=12则该粒子对应的元素在化合物中的化合价为_____;
(4)若m=17,且该粒子为食盐的一种组成微粒,则该粒子的化学符号为_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线图,请根据曲线信息回答问题:
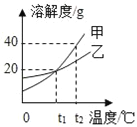
(1)t2℃时,将30克固体甲充分溶解于100克水中,可形成溶液的质量是______克.
(2)t1℃时,将30克固体乙充分溶解于100克水中,所形成溶液里溶质与溶剂的质量比是______.
(3)将t2℃时乙的不饱和溶液降温到t1℃时恰好达到饱和状态,溶质的质量分数是______(填“不变”、“变大”或“变小”).
(4)将t2℃时等质量的甲、乙饱和溶液降温到t1℃,析出晶体质量较多的是______(填“甲”或“乙”)
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。
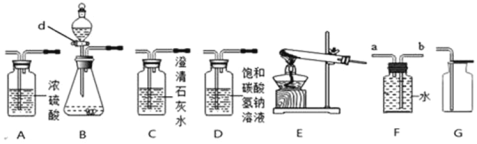
(1)实验室常用无水醋酸钠和碱石灰两种固体药品加热的方法制取甲烷气体。通常情况下,甲烷是没有颜色、没有气味的气体,比空气轻,极难溶于水。若要制取一瓶甲烷,如果选用F装置收集甲烷,气体应从_______(填“a”或“b”)端管口通入。
(2)若选用装置B作为制取氧气的发生装置,写出制取氧气的化学方程式__________________,设计装置B时使用仪器d的目的是_________________。
(3)某化学兴趣小组的同学查阅资料发现:实验室用石灰石和稀盐酸制取二氧化碳气体时,通常会混有少量的氯化氢气体,常用饱和的碳酸氢钠溶液除去二氧化碳中氯化氢气体。该组同学欲制取并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。所选仪器的连接顺序为___________________(从左至右填写仪器序号字母)。
相关试题

