【题目】如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )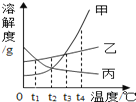
A. t1℃时,乙、丙两种物质的溶液中溶质质量分数一定相等
B. 将t2℃时甲、乙、丙的饱和溶液分解升温至t3℃,所得溶液的溶质质量分数由大到小的顺序是:乙>甲>丙
C. t4℃时,将等质量的甲、乙、丙三种固体分别配制成饱和溶液,需加水质量最多的是甲
D. 甲中混有少量乙时,应采用蒸发结晶的方法提纯甲
参考答案:
【答案】B
【解析】A.根据溶液是否饱和分析解答;
B.根据饱和溶液溶质质量分数分析解答;
C.根据物质的溶解度分析解答;
D. 据A、B的溶解度受温度影响情况分析提纯物质的方法。
解:A. t1℃时,乙、丙两种物质的溶解度相等,若溶液为饱和溶液,则溶质质量分数一定相等。但题中溶液是否饱和不确定,故错误;
B. 据图可知:甲、乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小;将t2℃时甲、乙、丙的饱和溶液分解升温至t3℃。甲、乙溶质质量不变,溶剂质量不变,溶质质量分数不变,丙析出晶体,依然是饱和溶液。又t2℃时甲、丙的溶解度相同,此时甲、丙饱和溶液溶质质量分数相等,而甲升温后变为不饱和溶液,溶质的质量分数与升温前相等,据饱和时质量分数的计算式![]() ×100%,可知溶解度越大质量分数也就越大,故所得溶液的溶质质量分数由大到小的顺序是:乙>甲>丙。正确;
×100%,可知溶解度越大质量分数也就越大,故所得溶液的溶质质量分数由大到小的顺序是:乙>甲>丙。正确;
C. t4℃时,甲、乙、丙三种物质的溶解度大小关系是甲>乙>丙,即等质量的水能溶解的溶质质量为甲>乙>丙,所以用等质量的甲、乙、丙配成t3℃时饱和溶液所需水的质量是丙>乙>甲。故错误;
D. 由于甲物质的溶解度随温度的升高而增加且受温度的影响变化较大,当甲物质中混有少量乙物质时,可采用降温结晶的方法得到较纯净的甲物质。故错误。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将KCIO3和MnO2的混合物25g加热到不再放出气体时,得到剩余固体15.4g,则反应中生成的氧气的质量为
A.9.6g B.14.9g C.0.5g D.3.2g
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下是实验室制取气体的常用仪器,回答列问题。

(1)标号为e的仪器名称是 ;
(2)用2KMnO4
 K2MnO4 + MnO2 + O2↑制取O2,并用向上排空气法收集。
K2MnO4 + MnO2 + O2↑制取O2,并用向上排空气法收集。①若制取3.2g O2,理论上至少需要KMnO4 g;
②检验O2收集满的方法是 ;
(3)用大理石和稀盐酸反应制取CO2,并用排水法收集;
①该反应的化学方程式为 ;
②组装制取置时,需选择上图中的a、b、h、i、k、l、m和 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下表数,回答问题。

(1)20℃时KNO3的溶解度是 g;
(2)60℃时,200g KNO3溶液中含溶质100g,将该溶液降温至20℃,可析出KNO3 g;
(3)NaCl溶液中含有少量KNO3,提纯NaCl,采用的方法是 (选填“蒸发结晶”或降温结晶”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】节约用水和合理开发利用水资源是每个公民应尽的责任和义务,你认为下列做法与之不相符的是
A.洗菜,洗衣,淘米的水用来浇花,拖地,冲厕所
B.将活性炭放入硬水中使其软化
C.合理施用农药、化肥,以减少水体污染
D.加强工业废水的排放监控,坚持达标排放
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据图示回答问题.
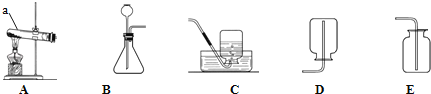
(1)仪器a的名称是 .
(2)实验室可以用一种盐类物质制取氧气,选用的发生装置是 (填标号),反应的化学方程式为 .若用排空气法收集氧气,写出验满的方法: .
(3)实验室用石灰石和稀盐酸反应制取二氧化碳.反应化学方程式为 ,选用的收集装置是 (填标号),选用发生装置B中长颈漏斗末端要伸入液面下的理由是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列归纳和总结完全正确的一组是( )
A.化学反应基本类型
B.化学反应中常见的“三”
①化合反应:4P+5O2
 2P2O5
2P2O5②分解反应:H2CO3═H2O+CO2↑
③置换反应:3CO+Fe2O3
 2Fe+CO2
2Fe+CO2①煤、石油、天然气﹣三大化石燃料
②塑料、合成纤维、合成橡胶﹣三大合成材料
③分子、原子、离子﹣构成物质的三种粒子
C.对鉴别方法的认识
D.化学与生活
①区分氮气和氧气﹣伸入带火星的木条
②区分棉纤维和羊毛纤维﹣点燃后闻气味
③区分硫酸铵和氯化铵﹣加熟石灰粉末研磨
①用甲醛水溶液浸泡水产品防腐
②缺乏维生素C易患坏血病
③自行车支架喷油器防锈
A.A B.B C.C D.D
相关试题

