【题目】以下改进实验能够更好地达成实验目的。
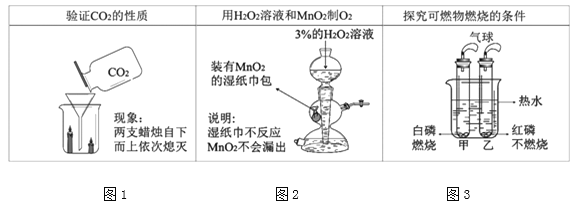
图1实验说明了二氧化碳具有的性质是_______;
按图2所示进行实验可以制取氧气,用启普发生器制取氧气的优点是_______(写一点),写出该反应的化学方程式_______;
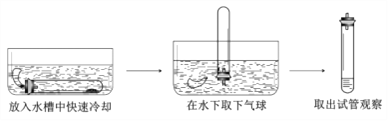
图3实验证明了可燃物燃烧的条件之一为_______,写出白磷燃烧的化学方程式_______;待图3实验结束后,将甲试管从烧杯中取出并按下图进行实验。若白磷足量,理论上进入试管中的水的体积约占试管容积的_______。
参考答案:
【答案】密度比空气大、不能燃烧、不能支持燃烧可随时控制反应的发生和停止2H2O2![]() 2H2O+O2↑可燃物燃烧温度需达到着火点4P+5O2
2H2O+O2↑可燃物燃烧温度需达到着火点4P+5O2![]() 2P2O51/5
2P2O51/5
【解析】(1).实验中可观察到蜡烛由低到高依次熄灭,所以可推知二氧化碳的性质有: 密度比空气大、不能燃烧、不能支持燃烧 (2). 关闭弹簧夹,容器内气体增多,压强变大,在压力的作用下,容器内液面下降,当液面下降到细颈下边时,固体反应物与液体分离,反应停止;反之,打开弹簧夹,反应开始。所以用启普发生器制取氧气的优点是可随时控制反应的发生和停止 (3).过氧化氢溶液和二氧化锰在常温下反应生成氧气,反应方程式为; 2H2O2![]() 2H2O+O2↑ (4). 燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;实验3中白磷燃烧,红磷不燃烧,说明可燃物燃烧温度需达到着火点 (5).磷和氧气点燃条件下生成五氧化二磷,反应方程式为 4P+5O2
2H2O+O2↑ (4). 燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;实验3中白磷燃烧,红磷不燃烧,说明可燃物燃烧温度需达到着火点 (5).磷和氧气点燃条件下生成五氧化二磷,反应方程式为 4P+5O2![]() 2P2O5 (6). 测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶、试管内气体减少,压强变小,水倒流入试管内,倒流的水的体积就等于试管内氧气的体积。理论上进入试管中的水的体积约占试管容积的 1/5
2P2O5 (6). 测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶、试管内气体减少,压强变小,水倒流入试管内,倒流的水的体积就等于试管内氧气的体积。理论上进入试管中的水的体积约占试管容积的 1/5
-
科目: 来源: 题型:
查看答案和解析>>【题目】稀释浓硫酸时,一定要将__________慢慢注入水中,用________不断地搅拌,使热量迅速扩散,切不可将水注入浓硫酸中.
-
科目: 来源: 题型:
查看答案和解析>>【题目】写出下列物质的名称或化学式:
名 称
氮气
二氧化硫
五氧化二磷
化学式
Al
Fe2O3
NaCl
-
科目: 来源: 题型:
查看答案和解析>>【题目】“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来。请回答:
探究二氧化碳与水的反应
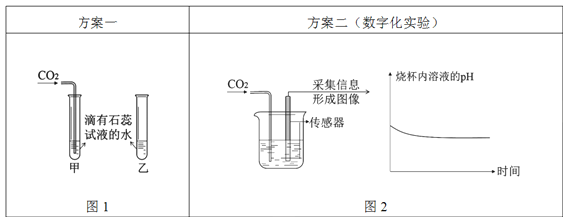
Ⅰ.图1中可观察到甲试管中的紫色液体变为_______色,写出发生反应的化学方程式_______,乙试管的作用是_______;
Ⅱ.由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变_______(填“强”或“弱”)。
探究蜡烛燃烧的产物

Ⅰ.如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到_______,证明反应生成了二氧化碳;若将干冷的烧杯罩在火焰上方,观察到_______,证明反应生成了水。
Ⅱ.如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,曲线_______(选填“a”、“b”、“c”)能够说明蜡烛燃烧生成了二氧化碳和水。
③ 比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
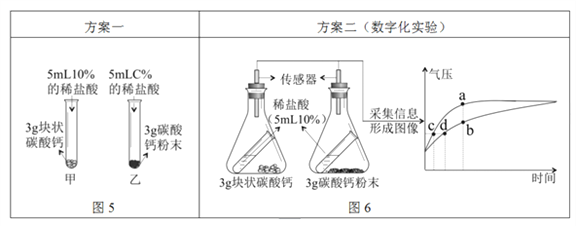
Ⅰ.写出碳酸钙与稀盐酸发生反应的化学方程式_______;
图5中,乙试管中稀盐酸的浓度C%应为_______;
较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是_______。
Ⅱ.按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示。对比分析坐标图中的点_______(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短。
-
科目: 来源: 题型:
查看答案和解析>>【题目】NaOH溶液的pH____7(填“>”、“<”或“=”),滴加酚酞试液后,溶液呈_________色,向此溶液中滴加盐酸,恰好完全反应后,pH_______7(填“>”、“<”或“=”),此时溶液呈____色.
-
科目: 来源: 题型:
查看答案和解析>>【题目】NaOH固体敞口放置在空气中,因吸收________而潮解,这种变化属于________,因吸收________而变质,这种变化属于________,因此NaOH固体必须________保存.
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据题意回答。
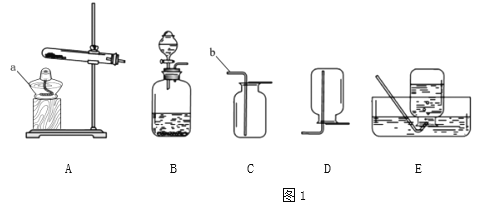
①写出仪器名称:a_______,b_______;
②实验室用氯酸钾和二氧化锰的混合物制取氧气,可选择的一组装置是_______(填编号)写出反应的化学方程式_______;
③下图是检查装置气密性的过程。最终在F处观察到的现象是_______(选填“甲~丁”);

④ 资料表明:高铁酸钾(K2FeO4)固体也能用于制取氧气,原理如下:
方案一:4K2FeO4
 2Fe2O3+4K2O+3O2↑
2Fe2O3+4K2O+3O2↑ 方案二:4K2FeO4+10H2O→4Fe(OH)3↓+8KOH+3O2↑
Ⅰ.关于以上方案说法错误的是_______
a.方案一是分解反应
b.方案二更节能简便
c.方案一、二均可在图1的装置B中进行实验
d.制取等质量的氧气,两种方案所需高铁酸钾的质量相等
Ⅱ.若用方案一(4K2FeO4
 2Fe2O3+4K2O+3O2↑)制取0.3mol氧气,需要高铁酸钾的物质的量为_______ mol(根据化学方程式列式计算)。
2Fe2O3+4K2O+3O2↑)制取0.3mol氧气,需要高铁酸钾的物质的量为_______ mol(根据化学方程式列式计算)。
相关试题

