【题目】我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L。
(1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g。
(2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。
参考答案:
【答案】C
【解析】
(1)二氧化碳的质量m=ρV=2.2g.
(2)设碳酸钙的质量为x,生成的氯化钙的质量为y,
则CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
x y 2.2g
100:x ="111:y" ="44:2.2g" ,
解得x=5g,y=5.55g,
该样品中碳酸钙的质量分数为![]() ×100%=66.7%,
×100%=66.7%,
(3)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为7.5g+34.7g-2.2g=40g,溶质的质量为5.55g,则溶质的质量分数为![]() ×100%=14.8%,
×100%=14.8%,
-
科目: 来源: 题型:
查看答案和解析>>【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
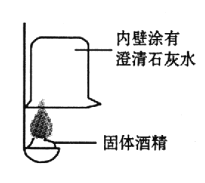
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案
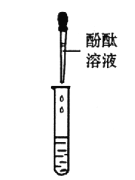
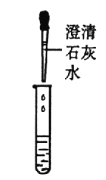
实验现象
溶液变红
产生______________
实验结论
清液中有氢氧化钠
清液中有碳酸钠
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
-
科目: 来源: 题型:
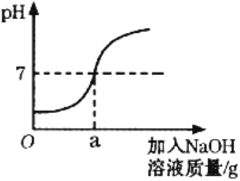
查看答案和解析>>【题目】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少____________(结果精确到0.1%)?
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙、丙三种物质的溶解度曲线,下列说法不正确的是
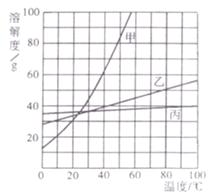
A. 甲的溶解度受温度影响最大
B. 10℃时,三种物质的溶解度大小顺序为丙>乙>甲
C. 30℃时,乙、丙两种物质的饱和溶液溶质质量分数相等
D. 50℃时,分别将40g甲、乙两种物质放入100g水中,均得到饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)下图是一种家用电热水壶,所用材料属于合金的是________ (填字母序号,下同),属于单质的是_______, 属于合成材料的是____;
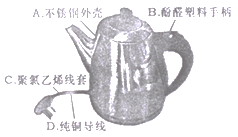
(2)学习化学需要在宏观物质的性质与其微观结构之间建立联系。
1个CO2分子由_____构成。在氢氧化钠、氯化钠、硫酸三种物质中,由阴阳离子构成的是____,这三种物质的水溶液中pH<7的是______。
(3)A~G七种物质之间具有如下图所示转化关系。已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%;C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料。请回答下列问题:
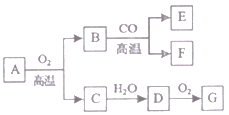
①A的化学式为______ ,已知A转化为B时金属元素的化合价升高,则A中非金属元素的化合价是____。
②B与CO反应的化学方程式是______________。
③C→D反应的化学方程式是________。
④B与G的稀溶液反应的化学方程式是________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验。
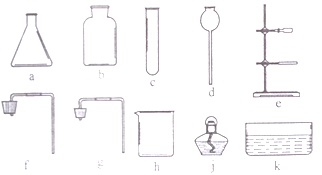
①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是________(填序号),收集氧气应采取_______法。
②提纯粗盐时,过滤需要选用上述仪器中的________(填序号),除此之外还缺少的仪器是滤纸、____、_______(填名称)。
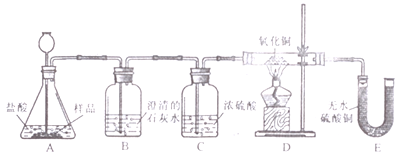
(2)美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3;灰白色粉末应该含有CaCO3和Fe;为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
(实验目的)证实灰白色粉末中含有CaCO3和Fe。
(实验设计)装置如下图所示:
(实验预测与分析)
①若要证实样品中含有CaCO3,观察到的实验现象是____,B中发生反应的化学方程式为____________。
②若要证实样品中含有Fe,E中应观察到的现象是________。此时C装置的作用是______。
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式_________。
-
科目: 来源: 题型:
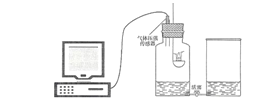
查看答案和解析>>【题目】某科学兴趣小组对“测定空气中氧气含量”的实验进行了改进:将数显设备、气体压强传感器和空气中氧气含量测量装置按下图连接。装置气密性良好,调节右边敞口容器和集气瓶里的水面相平,此时集气瓶内气体的体积为V1。关闭活塞,点燃燃烧匙内的红磷,立即塞紧瓶塞,待火焰熄灭后,过一段时间打开活塞,观察到集气瓶中的水位上升。待集气瓶内的水面不再上升时,集气瓶内的气体体积为V2。然后向右边容器内加入一定量的水至两边水面再次相平,此时集气瓶内的气体体积为V3。在点燃红磷至打开活塞这一过程中,观察到数显设备显示集气瓶内的气体压强先上升后下降,再趋于稳定。
请回答:
(1)数显设备显示,开始一段时间集气瓶内气体压强上升,这是因为温度升高导致的气压变化量___________(选填“大于”、“ 等于”或“小于”)氧气量减少导致的气压变化量。
(2)基于数显设备显示的气压变化,“过一段时间打开活塞”中的“一段时间”指的是火焰熄灭后到_______________所经历的时间。
(3)在整个实验过程中,集气瓶中减少的氧气体积为______________(选填“V1-V2”、“ V1-V3”或“V2-V3”)。
相关试题

