【题目】小金为探究铁制品锈蚀的条件,进行如下实验:
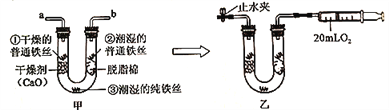
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。
观察对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是_______。
(2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。
参考答案:
【答案】 将带火星的木条放置在b管口,若木条复燃,则证明U形管内已经充满氧气; 观察到注射器活塞向左移动(或注射器内的氧气体积减少) 水分和金属的内部结构
【解析】根据所学知识和题中信息知,(1)步骤1中,检查U形管内是否已充满O2的方法是将带火星的木条放置在b管口,若木条复燃,则证明U形管内已经充满氧气。(2)铁制品锈蚀的条件之一是需要O2,在此实验中能支持此条件的证据是观察到注射器活塞向左移动(或注射器内的氧气体积减少),氧气与铁反应,容器内气压减小。(3)通过对比实验现象,此实验还可得出铁制品锈蚀的条件是水分和金属的内部结构。
点睛∶铁生锈是金属铁与空气中氧气和水蒸气共同作用的结果。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金作出下列判断,其中不合理的是
A. “立即出现红色固体”是由于很快发生了如下转化:CuO
 CuSO4
CuSO4 Cu
CuB. “产生大量无色气泡”是由于发生了如下反应:Fe+H2SO4=FeSO4+H2↑
C. 该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应
D. 在不同浓度的硫酸铜和稀疏酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】CO2的转化和利用是一个热门的研究课题。回答下列相关问题:
(1)2016年我国科研人员研制出一种“可呼吸CO2”的电池,放电时该电池“吸收CO2”,充电时该电池“放出CO2”。放电时,金属钠和CO2发生置换反应生成一种非金属单质和一种常见的盐,写出此反应的化学方程式_________。
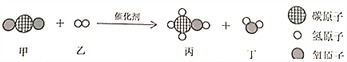
(2)2018年5月,某杂志介绍了我国的一项研究成果:在一种新催化剂作用下可实现二氧化碳高效转化为甲醇,相关反应如图所示,参加反应的甲和乙的分子个数之比为_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碱式碳酸锌[Znx(OH)y(CO3)z]是制备功能材料ZnO的原料,其化学反应表达式为: Znx(OH)y(CO3)z
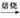 ZnO+CO2↑+H2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
ZnO+CO2↑+H2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
(1)图甲中装置B的作用是___________。
(2)查阅资料发现在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到______℃(选填“200”、“300”或“100”)。
(3)部分实验步骤为:“……加热前先通入N2排尽装置内的空气,关闭通入N2的活塞,……控制一定温度下加热……”。实验过程中可根据_____现象判断碱式碳酸锌样品已完全分解。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用“盐酸——硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
表 H2S回收工艺的各项生产成本
项目
单价(元/吨)
NaOH
2500
Na2S
5000
辅助费用(以处理1吨H2S计)
1114
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H2S的方法是______(选填“盈利”或“亏损”)的。
(2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨__________?(写出计算过程,结果保留1位小数)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像能够正确反映其对应变化关系的是
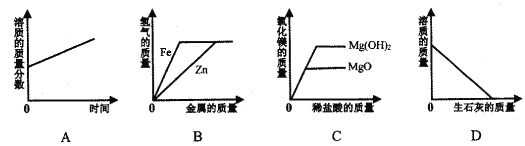
A. 将浓硫酸露置在空气中一段时间
B. 向等质量等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉
C. 向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸至过量
D. 向一定质量的饱和石灰水中,加入足量的生石灰
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一包不纯的碳酸钾粉末,所含杂质可能是硝酸钾、硝酸钙、氯化钾、氯化亚铁、碳酸钠中的一种或几种。为确定其成分,进行如下实验:
(1)取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液。向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失。
(2)另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,生成19.7g白色沉淀。
(资料:稀硝酸与碳酸盐能发生复分解反应,稀硝酸与氯化银不反应)
下列说法正确的是
A. 杂质中一定不含有氯化亚铁
B. 杂质中一定含有氯化钾,可能含有硝酸钾、碳酸钠
C. 该包粉末的组成只有两种情况
D. 所用氯化钡溶液中溶质的质量分数为20.8%
相关试题

