【题目】从海水中可制备纯碱和金属镁,其流程如下图所示。
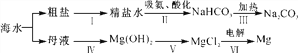
(1)粗盐提纯时,每步操作都会用到的一种玻璃仪器是________(填仪器名称)。
(2)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下列物质:
a.适量的盐酸 b.稍过量的Na2CO3溶液
c.稍过量的Ba(OH)2溶液
利用过滤等操作进行除杂,则加入这三种物质的先后顺序为________(填字母序号)。
(3)向饱和的氯化铵溶液中通入氨气和二氧化碳,经过一系列变化,最终可制得纯碱。请写出第Ⅲ步反应的化学方程式________________________________________。
(4)第Ⅴ步Mg(OH)2与盐酸的反应________(填“是”或“不是”)中和反应。
参考答案:
【答案】 玻璃棒 cba 2NaHCO3![]() Na2CO3+CO2↑+H2O 是
Na2CO3+CO2↑+H2O 是
【解析】(1)粗盐提纯时,在溶解、过滤、蒸发的过程中都会用到的 玻璃仪器是玻璃棒;(2)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,为除杂完全并不引进新杂质,试剂的滴加顺序为c.稍过量的Ba(OH)2溶液除去硫酸根离子和金属镁离子;再加入碳酸钠溶液,除去钙离子,最后滴加盐酸;(3)(3)向饱和的氯化铵溶液中通入氨气和二氧化碳,经过一系列变化,最终可制得纯碱。 第Ⅲ步反应的化学方程式为2NaHCO3![]() Na2CO2+CO2↑+H2O ;(4)第V步Mg(OH)2与盐酸的反应属于中和反应。
Na2CO2+CO2↑+H2O ;(4)第V步Mg(OH)2与盐酸的反应属于中和反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验现象的描述中,正确的是
A.硫在氧气中燃烧产生淡蓝色火焰
B.电解水时用带火星的木条检验负极产生的气体:带火星的木条复燃
C.把盛有浓盐酸的试剂瓶塞打开后,瓶口上方会出现白烟
D.向硫酸铜溶液中滴加氢氧化钠溶液,产生蓝色沉淀
-
科目: 来源: 题型:
查看答案和解析>>【题目】某种植蔬菜的专业户,不慎用污水浇灌了蔬菜,蔬菜上市销售时检测出其中铅、铜、铬等重金属含量超标,这里提到的铅、铜、铬是指
A.原子 B.元素 C.分子 D.单质
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是生命之源,为了人类健康,我们应该爱护水资源。请回答下列问题。
(1)自制简易净水器中的活性炭具有 性。
(2)净水器中小卵石和石英砂起到 作用。
(3)在常用净水方法中,净化程度最高的是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】取6.4g表面部分被氧化的镁条放入烧杯中,加入100g溶质质量分数为19.6%的稀硫酸,恰好完全反应,则反应后生成硫酸镁的质量为 g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中处处充满着化学。从化学的角度看,下列说法中正确的是
A. 煤气泄露,立即打开排气扇的电源开关
B. 室内起火,迅速打开所有门窗通风
C. 炒菜时油锅着火,可立即加水灭火
D. 扑灭电器、图书档案等火灾最适宜的灭火器是液态二氧化碳灭火器
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关碳和碳的氧化物的说法中不正确的是
A.金刚石和石墨的结构中碳原子排列方式相同
B.工业中利用活性炭脱色以制白糖
C.室内放盆水不能防止一氧化碳中毒
D.CO2可用于灭火,CO可用作燃料
相关试题

