【题目】下图是灭火器原理模拟示意图。
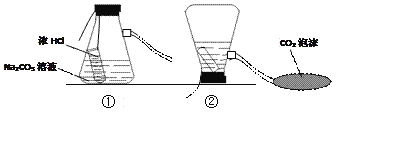
(1)上述装置②发生反应的化学方程式是_______________________。
(2)CO2灭火的原理是_______________________。
(3)某同学对装置②反应后的溶液中溶质的成分进行探究。
(查阅资料)氯化银不溶于酸
(提出猜想)装置②反应后的溶液中溶质为:
I.________;II.HCl和NaCl;III.Na2CO3和NaCl。
(进行实验)
实验装置及操作 | 实验现象与结论 |
a.取装置②反应后的溶液于试管中,加入足量稀HNO3。 b.继续向a的溶液中滴加_______。 | c.有气体产生;猜想1、猜想II不成立。 d.__________;反应的化学方程式是________________,猜想III成立。 |
(拓展与思考)如果猜想II成立,产生此结果的原因是实验时____________________。反应后溶液溶质不可能出现的组合是NaCl、Na2CO3、HCl,原因是__________。
参考答案:
【答案】 Na2CO3 +2HCl = 2NaCl + CO2↑ + H2O 使可燃物与氧气隔绝 NaCl AgNO3 白色沉淀 AgNO3 + NaCl = AgCl↓ + NaNO3 HCl过量 HCl与Na2CO3
不能共存。
【解析】本题考查了酸、盐的化学性质。要考虑反应物的量对反应后溶液溶质成分的影响。
(1)装置②发生的反应是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式是Na2CO3 +2HCl = 2NaCl + CO2↑ + H2O;
(2),二氧化碳一般不能燃烧也不能支持燃烧,密度大于空气。CO2灭火的原理是使可燃物与氧气隔绝
(3)提出猜想:装置②发生的反应是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,恰好完全反应时溶液中的溶质是NaCl,当盐酸过量时,溶液中的溶质是HCl和NaCl;当碳酸钠过量时,溶液中的溶质是Na2CO3和NaCl。所以猜想I是NaCl;
进行实验:若猜想III成立,溶质中除了Na2CO3还有NaCl,硝酸银溶液与NaCl反应产生不溶于酸的氯化银。为了证明NaCl的存在,可继续向a的溶液中滴加AgNO3溶液,若产生白色沉淀,则猜想III成立,反应的化学方程式为:AgNO3 + NaCl = AgCl↓ + NaNO3;
拓展与思考:如果猜想II成立,产生此结果的原因是实验时HCl过量;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。反应后溶液溶质不可能出现的组合是NaCl、Na2CO3、HCl,原因是HCl与Na2CO3不能共存。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为探究物质的燃烧条件,某同学进行了如下图所示的实验。
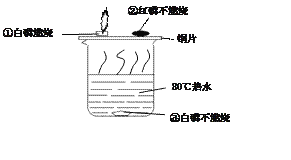
(1)能说明物质燃烧需要氧气的现象是 ________(填序号,下同)。
(2)能说明红磷比白磷着火点高的现象是_______。
(3)白磷燃烧的化学反应方程式是_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】初中化学常见物质A~G是下列物质中的一种:铁、生石灰、熟石灰、烧碱、稀盐酸、稀硫酸、氯化铜溶液。相互关系如图所示,“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物以及反应条件省略)“”表示相互之间不反应。其中A是常见的食品干燥剂。
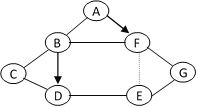
(1)A的化学式是__________。
(2)写出F的一种用途__________________。
(3)C参加_________反应(填反应类型)。
(4)B转化为D需与_______反应(填物质化学式)。
(5)E + G的反应化学方程式为____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、MgO等。研究小组对其进行综合处理的流程如下:
资料1:SiO2、Al2O3溶于浓氢氧化钠溶液。
资料2:MgCl2溶液加热容易水解生成Mg(OH)2。
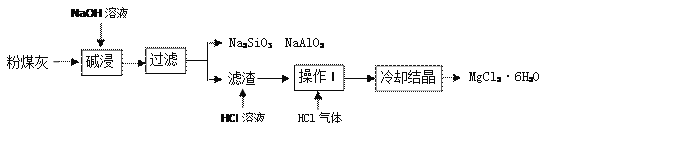
(1)碱浸溶解SiO2(性质与CO2相似)的化学反应方程式为_____________。
(2)粉煤灰碱浸需在较高温度下进行,原因是__________________。
(3)滤渣中加入稀盐酸发生的化学反应方程式是____________________。
(4)操作I是_________________,通入HCl气体的目的是_________________。
(5)化石燃料除煤外还有____________,人们开发和应用的清洁能源有_________(写出两种即可)。
-
科目: 来源: 题型:
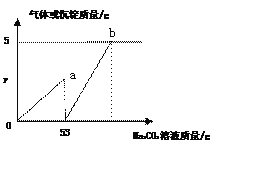
查看答案和解析>>【题目】某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少______?(写出计算过程)
(3)y=____。
(4)b点对应的溶液的溶质是(填化学式)_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算:
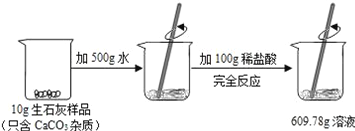
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
-
科目: 来源: 题型:
查看答案和解析>>【题目】近日,我国企业成功研发圆珠笔笔头用新型不锈钢材料,标志着笔头用材料的国产化、自主化进程迈出了关键一步。笔头不锈钢材料中含有碳、铁、钨等元素。如图是其元素的部分信息。下列说法正确的是

A. 碳元素只能形成二种单质
B. 铁原子中有30个中子
C. 一个钨原子的质量为183.84g
D. 笔头不锈钢材料中全是金属元素
相关试题

