【题目】(1)氯气(Cl2)在净水、工业生产中用途广泛,用Cl2制备漂白液时有如下反应:Cl2+2NaOH==NaCl+NaClO+H2O,请回答下列问题:
①Cl-的原子结构示意图为 ,生成物NaClO中氯元素的化合价为 。
②20 ℃时,NaCl的溶解度为36 g。该温度下,饱和NaCl溶液中溶质与溶剂的质量之比为 。
(2)我们的星球因水而美丽,水也是宝贵的自然资源。
①电解水的化学方程式为 。
②生活用水在净化过程中常用 吸附色素和异味。一般可以通过 的方法降低水的硬度。
③Fe在高温条件下可与水蒸气反应生成一种单质和一种黑色的氧化物,该氧化物是磁铁矿的主要成分,写出该反应的化学方程式 。
(3)A~F是初中常见的化合物,有如下转化关系(部分生成物已省略)。其中A是大理石的主要成分,C可用于灭火,F俗名纯碱。
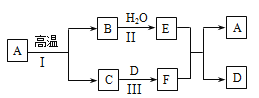
请回答下列问题:
①E的俗名为 ,写出物质E在农业上的一种用途 ,E与F反应的化学方程式为 。
②反应I的化学方程式为 ,该反应是 反应(填基本反应类型)。
③A、E均能与盐酸反应,反应的化学方程式分别为 、 。
参考答案:
【答案】(1)① 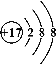 +1 ② 9∶25
+1 ② 9∶25
(2)① 2H2O通电2H2↑+ O2↑
②活性炭 加热煮沸 ③3Fe + 4H2O高温Fe3O4 + 4H2↑
(3)①熟石灰(消石灰) 改良酸性土壤(配置农药波尔多液)
Ca(OH)2 + Na2CO3 == 2NaOH + CaCO3↓
②CaCO3高温CaO + CO2↑ 分解 ③CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
【解析】
试题分析:(1)①氯原子由17个质子和17个电子构成,故氯离子结构是得到最外层1个电子,故结构示意图为: 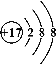 ;根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在次氯酸钠(NaClO)中Na的化合价为+1,O的化合价为-2,故Cl的化合价为+1
;根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在次氯酸钠(NaClO)中Na的化合价为+1,O的化合价为-2,故Cl的化合价为+1
②20℃时,NaCl的溶解度为36g,表示该温度下,100g水中最多溶解NaCl的质量为36g,故饱和NaCl溶液中溶质与溶剂的质量之比=36:100=9∶25
(2)①电解水的化学方程式为:2H2O通电2H2↑+ O2↑;
②生活用水在净化过程中常用活性炭吸附色素和异味。一般生活中可以通过加热煮沸的方法降低水的硬度,实验室通过蒸馏的方法降低水的硬度
③ Fe在高温条件下可与水蒸气反应生成一种单质和一种黑色的氧化物,化学方程式为:3Fe + 4H2O高温Fe3O4 + 4H2↑
(3)框图式的推断题,抓住一些特殊的反应现象、特殊的性质及特殊的反应条件等级题目的“题眼”, 该题的题眼:A是大理石的主要成分,可判断A为碳酸钙,C可用于灭火,可判断为二氧化碳,则B为氧化钙,那么E为氢氧化钙,F俗名纯碱,为碳酸钠,故可判断D为氢氧化钠
① E为氢氧化钙,俗名为熟石灰(消石灰);在农业上的一种用途:改良酸性土壤(配置农药波尔多液);E为氢氧化钙,F为碳酸钠,两者反应的化学方程式为:Ca(OH)2 + Na2CO3 == 2NaOH + CaCO3↓
②反应I为高温煅烧碳酸钙,化学方程式为:CaCO3高温CaO + CO2↑;该反应由一种物质生成两种物质,是分解反应
③ A为碳酸钙,能与盐酸反应,反应的化学方程式为:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;E为氢氧化钙,能与盐酸反应,反应的化学方程式为:Ca(OH)2 + 2HCl == CaCl2 + 2H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】盐酸先生走迷宫,前面有很多妖魔鬼怪会“吃掉”它(即与盐酸发生化学反应的物质,或物质的溶液),盐酸先生必须避开它,否则会被“吃掉”。
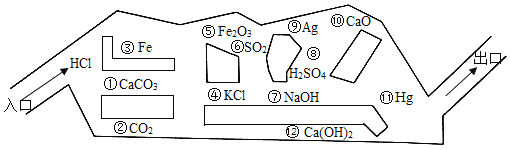
(1)试将盐酸走出迷宫不会被“吃掉”的路线,从入口至出口的顺序(用序号相连)_____________;
(2)写出“吃掉”盐酸的置换反应__________;
(3)盐酸想走捷径,从最近距离走出,却被“吃掉”,生成一种固体时叫“干冰”的气体,其化学方程式为__________;
(4)用迷宫中的物质检验(3)中生成气体的化学方程式为______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是初中化学中常见的实验装置图,请按要求完成问题。
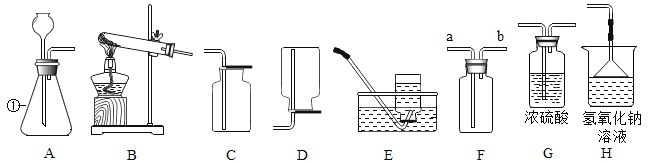
(1)写出标号①的仪器名称______________。
(2)用B装置与E装置制取纯净气体的化学方程式为____________________。
(3)用装置A与D相连制取气体的化学方程式________________。
(4)盐酸是氯化氢气体的水溶液,而氢硫酸是硫化氢气体的水溶液,实验室用硫化亚铁(FeS)固体和盐酸按复分解反应制取硫化氢气体,其制取装置与制取二氧化碳相同,但生成的硫化氢气体有毒,排放在空气中会污染空气:
①制取硫化氢气体的化学方程式为____________;
②将多余的气体用装置H吸收,其反应的化学方程式为_________,漏斗的作用是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分析下列实验图像,得到的结论正确的是
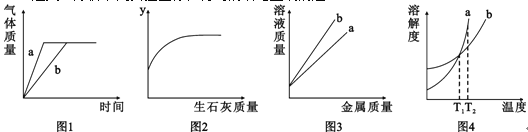
A.图1:双氧水溶液制氧气,a未使用催化剂,b使用了催化剂
B.图2:某温度下,向饱和石灰水中加入生石灰,则y轴可以表示溶质的质量分数
C.图3:分别向足量且等质量的盐酸中加入铁粉、锌粉,则曲线b代表的是加入锌粉的情况
D.图4:溶质为a、b的两质量相等的饱和溶液,温度由T2降至T1,分别析出不含结晶水的a、b固体,则最终两溶液质量相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)下图所示装置有多种用途。若用于收集H2,H2应从该装置的 (填“a”或“b”)口通入。用该装置除去H2中少量的HCl气体,广口瓶中应该加入的试剂为 ,该试剂不能用饱和NaHCO3溶液代替,原因是 (用化学方程式说明)。

(2)铝化学性质很活泼,通常铝制品却很耐腐蚀,原因是 。铝还有特殊的性质,能溶解于NaOH溶液中,完成化学方程式:

(3)子琛做“将浓硫酸滴到一块小布上”的实验,发现生成的炭上冒“白烟”,推测炭能与浓硫酸反应。欲探究其生成物成分,通过简单分析及实验确定无H2和O2,因此继续进行如下探究。
【查阅资料】① SO3能被浓硫酸及水吸收
② SO2性质:能使品红褪色,能被高锰酸钾溶液吸收,能使澄清石灰水变浑浊
③ CO可与PdCl2溶液反应:PdCl2 + CO + H2O == Pd(黑)↓ + 2HCl + CO2;不与KMnO4溶液反应
【提出猜想】生成物的成分可能为Ⅰ H2O、CO、SO2 Ⅱ H2O、CO2、SO2
Ⅲ H2O、CO、CO2、SO2
【实验验证】子琛设计了如下实验:

【分析讨论】
①请根据实验目的,按气流从左到右的方向将实验仪器组装完整:
A→ → →D→ 。
② 装置E中所加药品是 ,作用是 。
③ 装置C中②的作用是除去SO2气体,则③试管中品红溶液的作用是 。
④若D中澄清石灰水变浑浊,方程式为 。
⑤实验结束冷却后,从实验安全角度考虑,清洗装置A中试管时不能直接向其中加水冲洗,原因是 。
【实验结论】实验观察到的部分现象是:B中未见黑色沉淀,则猜想 正确,写出炭与浓硫酸在加热条件下反应的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应既是化合反应,又是氧化反应的是
A.木炭在空气中燃烧 B.过氧化氢制氧气
C.加热碳酸氢铵 D.二氧化碳和水反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】向100 g CuSO4与H2SO4的混合溶液中加入质量分数为20%的氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:

(1)由图像可知,NaOH先与混合溶液中 发生反应。
(2)生成沉淀Cu(OH)2的质量是多少?
(3)当加入NaOH溶液的质量为40 g时,所得溶液中Na2SO4的质量分数是多少?(结果精确到0.1%)
相关试题

