【题目】Mg与NH4Cl溶液反应,除生成一种盐外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是HCl,NH3,H2中的一种或几种。
【查阅资料】①NH3+HCl=NH4Cl ②2NH3+H2SO4 =(NH4)2SO4
③2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
【实验探究】(1)为确定是否含有HCl,将气体通入酸化的 _______________溶液中,无沉淀产生,则该气体中无HCl。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
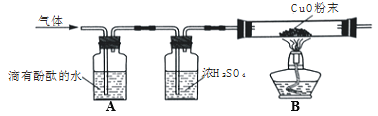
①A中观察到 __________________________,证明有NH3;
②B中玻璃管内观察到________________________________,证明有H2;
③浓硫酸的作用是_____________________________________________。
【实验结论】(3)Mg与NH4Cl溶液反应生成盐、NH3和H2 。写出化学方程式______________。
【实验反思】(4)综合以上信息和实验结论,有同学认为不需要单独检验HCl,就能证明HCl不存在。请评价这种说法是否合理 ________(填“是”或“否”),理由是__________。
参考答案:
【答案】 硝酸银(或AgNO3) 酚酞溶液变红色 黑色粉末变红色,玻璃管内壁有水珠 除去氨气,干燥氢气 Mg+2NH4Cl=MgCl2+2NH3↑+H2↑ 是 氯化氢与氨气不共存(或HCl与NH3反应生成NH4Cl固体等)
【解析】硝酸银能和稀盐酸反应生成白色沉淀氯化银和硝酸;
氨气能和水反应生成氨水,氨水显碱性,能使酚酞试液变红色;
加热条件下,氧化铜能和氢气反应生成铜和水;
浓硫酸具有吸水性,能和氨气反应生成硫酸铵;
根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
根据提供的信息可以判断相关方面的问题。
解:【实验探究】(1)为了确定是否含有HCl,将气体通入酸化的硝酸银溶液中,无沉淀生成,则该气体中无HCl;
(2)①A中观察到酚酞溶液变红色,证明有NH3;
②B中玻璃管内观察到黑色粉末变成红色,玻璃管内壁出现水珠,证明有H2;
③浓硫酸的作用是除去氨气,干燥氢气;
【实验结论】
Mg与NH4Cl溶液反应生成MgCl2、NH3和H2,反应的化学方程式为:Mg+2NH4Cl═MgCl2+2NH3↑+H2↑;
【试验反思】
因为氨气能和氯化氢反应生成氯化铵,所以不需要单独检验HCl,就能证明HCl不存在。
故填:是;氯化氢与氨气不共存。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用元素符号和数字填空:
(1)二个铅原子_____________,(2)二氧化氮中氮元素显+4价_____,
(3)人体缺_______易导致甲状腺肿大,(4)碳酸__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现代社会对能源的需求量越来越大,能源的开发和利用备受人类关注。
(1)化石燃料包括煤、石油和______,它们都是________(填“纯净物”或“混合物”),石油经过精制后可得到汽油、柴油、煤油等产品,这是利用石油中各成分的______不同而将它们分离的。
(2)化石燃料不可再生,开发和利用新能源迫在眉睫,氢能作为理想的能源,重要原因是它的燃烧产物无污染,用化学反应方程式表示为_____________________。
(3)为减少大气污染,某发电厂采用了“石灰固硫法”,即在一定条件下向煤中掺入生石灰,用来吸收二氧化硫,已知这一过程中,各元素的化合价均未发生改变,写出“石灰固硫法”的化学方程式___________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答问题:
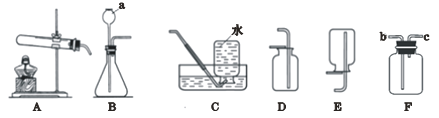
(1)A中作热源的仪器名称是_______,B中仪器a的名称是_______.
(2)制取和收集O2可选择装置B和C,反应的化学方程式为_____________;若要用装置F收集100ml氧气,你的做法是_____________________________。
(3)若用装置F检验二氧化碳是否与水反应,F中应盛放____________,二氧化碳气体应从____________(填b或c)端通入。
-
科目: 来源: 题型:
查看答案和解析>>【题目】李克强总理在2017年3月5日两会《政府工作报告》中强调:加大生态环境保护治理力度,坚决打好蓝天保卫战;推进生态保护和建设。下列做法不会对环境造成污染的是( )
A. 燃放烟花爆竹 B. 露天焚烧秸秆和垃圾
C. 大力植树造林 D. 大力发展火力发电
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)为延长食品保质期,常在食品中添加苯甲酸(C6H5COOH)作为防腐剂。回答下列问题:①苯甲酸是由 种元素组成;②苯甲酸中碳元素与氢元素的质量比为 (最简整数比)。
(2)小明称取黄铜(铜锌合金)样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,测得实验数据如图所示。

求:
①该铜锌合金中,铜和锌的质量比是 (最简整数比)。
②所用稀硫酸溶液中溶质的质量分数是多少?
-
科目: 来源: 题型:
查看答案和解析>>【题目】《史记孝文本纪》记载,汉文帝提倡节俭,他要求:“治霸陵(建造其陵墓)皆以瓦器,不得以金银铜锡为饰”,从化学的视角看,对于涉及到的物质,下列有关说法不正确的是( )
A. 当时的瓦器价值不如金银铜锡高
B. 金银铜锡的金属活动性逐渐减弱
C. 锡能与稀盐酸反应,而金银铜则不能
D. 铜能与硝酸银溶液反应,而金则不能
相关试题

