【题目】小亮在实验室发现一瓶盛有无色溶液的试剂,其标签破损,从残余部分只能看出溶质质量分数为10%。具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18 g后,认为该溶液不可能是氢氧化钙,理由是______________。
(2)小亮取少量样品于试管中,滴加________试液,试液变红色,该溶液不可能是________(填化学式),理由是________________________________________。
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告。
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成分;
方案乙:选择稀盐酸来确定该溶液的成分。
【进行实验】请你选择一种方案进行实验。
实验步骤 | 实验现象 | 实验结论 |
取少量溶液于试管中,滴加该物质 | _____________ | 该溶液是碳酸钠溶液。有关反应的化学方程式为:____________ |
【注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分】
(4)玉鹏同学认为还可以用一种不同于甲、乙类别的物质来确定,该物质可以为________________。
实验步骤 | 实验现象 | 实验结论 |
取少量溶液于试管中,滴加该物质 | ________________ | 该溶液是碳酸钠溶液。有关反应的化学方程式为:____________ |
参考答案:
【答案】 即便是常温下氢氧化钙的饱和溶液,其溶质的质量分数也不会超过0.18%,所以不可能是氢氧化钙溶液 酚酞 NaCl NaCl溶液是中性的,不能使酚酞变色 有白色沉淀产生(或有气泡产生) Na2CO3+CaCl2===2NaCl+CaCO3↓(或Na2CO3+2HCl===2NaCl+H2O+CO2↑) Ca(OH)2溶液 有白色沉淀产生 Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
【解析】分析:(1)氢氧化钙常温下的溶解度为![]() ,据此可计算出其饱和溶液的质量分数达不到
,据此可计算出其饱和溶液的质量分数达不到![]() ,所以可判断不可能为氢氧化钙;
,所以可判断不可能为氢氧化钙;
(2)从题目中分析,氢氧化钠、氯化钠、碳酸钠中只有氯化钠是盐,其余两种都是碱,所以应该是加入酸碱指示剂判断是否为氯化钠;
(3)鉴别氢氧化钠和碳酸钠,可以用氯化钙溶液,能产生碳酸钙沉淀,也可以采用稀盐酸,能产生气体,两种方法都可以;
(4)常见的碱溶液就是氢氧化钠和氢氧化钙,可用氢氧化钙鉴别氢氧化钠和碳酸钠,氢氧化钙和碳酸钠反应能产生碳酸钙沉淀;
解:(1)常温下氢氧化钙的溶解度为![]() ,其饱和溶液中溶质质量分数
,其饱和溶液中溶质质量分数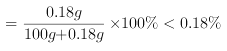 ,而该溶液溶质质量分数为
,而该溶液溶质质量分数为![]() ,所以不可能是氢氧化钙;
,所以不可能是氢氧化钙;
(2)从题中分析,能使试液变红色,指示剂为无色酚酞,而氯化钠是盐,显中性,不能使无色酚酞试液变红色,可以排除氯化钠;
(3)氯化钙和稀盐酸都可以用来鉴别氢氧化钠和碳酸钠,氯化钙与碳酸钠反应产生碳酸钙白色沉淀,方程式为![]() ═
═![]() ↓
↓![]() ,稀盐酸与碳酸钠反应产生二氧化碳气体,方程式为
,稀盐酸与碳酸钠反应产生二氧化碳气体,方程式为![]() ═
═![]() ;
;
(4)鉴别氢氧化钠和碳酸钠还可用澄清石灰水,能产生碳酸钙沉淀,方程式为![]() ═
═![]() ↓
↓![]() ;
;
因此,本题正确答案是:(1) 即便是常温下氢氧化钙的饱和溶液,其溶质的质量分数也不会超过0.18%,所以不可能是氢氧化钙溶液;
(2)酚酞、![]() ,
, ![]() 溶液呈中性,不能使无色酚酞试液变红色。
溶液呈中性,不能使无色酚酞试液变红色。
(3)实验现象:产生白色沉淀(或有气泡冒出)。![]() ═
═![]() ↓
↓![]() (或
(或![]() ═
═![]() 。
。
(4) Ca(OH)2溶液, ![]() 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作正确的是( )

A. 蒸发食盐水 B. 称量氢氧化钠 C. 稀释浓硫酸 D. 检验装置气密性
-
科目: 来源: 题型:
查看答案和解析>>【题目】酚酞(C20H14O4)是化学实验室常用的试剂。下列有关酚酞的说法中正确的是( )
①酚酞中碳元素的质量分数最大 ②酚酞由碳、氢、氧三种元素组成
③酚酞是由20个碳原子、14个氢原子和4个氧原子构成 ④酚酞的相对分子质量为318
⑤酚酞中碳、氢、氧元素的质量比为20∶14∶4
A. ①②③④⑤ B. ①②④ C. ②③④⑤ D. ①②④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】能用来放在防毒面具中吸附有毒气体的是( )
A.木炭 B.炭黑 C.活性炭 D.焦炭
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的化学式和相应的名称均正确的是( )
A.MgCl2 氯化镁 B.O3 氧气
C.O4Fe3 氧化铁 D.Fe(OH)2 氢氧化铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】将足量的红磷放在一个密闭、充满空气的容器中燃烧,燃烧后温度恢复到室温,压强保持不变,则容器中剩余的气体体积约为原气体体积的( )
A. 78% B. 21% C. 100% D. 无法判断
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气中氧气与氮气的体积比约为( )。
A. 4:1 B. 1:4 C. 1:5 D. 4:5
相关试题

