【题目】(1)下图是某学习小组在实验室制取气体时准备的一些装置,据图回答:
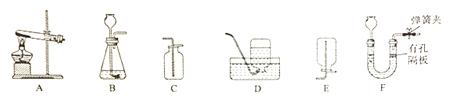
①实验室用高锰酸钾制取并收集较纯净氧气应选用的装置是___________(填序号)。
②选用装置B、C组合在实验室制取CO2,其验满的方法是______________。 若改用装置F制备CO2,其优点是________________。
(2)小雨同学在探究Al、Fe、Cu三种金属的活动性实验中,设计方案如下图:
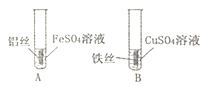
①B试管中观察到的实验现象有____________________。
②A试管中小雨在很长时间内都未观察到预期的实验现象,其原因可能是___________。
③实验成功后,小雨把两支试管中所有物质并倒入烧杯中,充分反应后,烧杯中仍有不溶性固体,为此,小雨继续展开探究。
[提出问题]不溶性固体中含有哪些成分?
[实验并得出结论]过滤,向滤出的不溶性固体滴加足量的稀硫酸,有气泡冒出,则该不溶性固体中一定含有的物质是____________,一定发生反应的化学方 程式是____________________。
[反思与评价]小军同学用表面积相等的以上三种金属片分别与等浓度等体积的稀盐酸反应完成同样的探究,却意外发现铁片中加稀盐酸后,溶液变为黄色,试分析其原因:________________(用化学方程式回答)。
[拓展应用]小军实验结束后,将废液集中,经检测其中盐酸过量,还需处理至pH=7后排放,处理废液时除需pH试纸外可供选择的下列物质中不适合的是_____________。 (填序号)
a.NaOH溶液 b.AgNO3溶液 c.NaHCO3溶液 d. 生石灰 e.石蕊试液
参考答案:
【答案】 A、D 用燃着的木条放在瓶口,若木条熄灭,则CO2已满 可控制反应的发生与停止 铁丝表面有红色固体析出 铝丝表面未砂纸打磨 Fe和Cu Fe+H2SO4=FeSO4+H2↑ Fe2O3+6HCl=2FeCl3+H2O b、e
【解析】(1) ①根据反应物的状态、反应条件及生成较纯净的氧气分析解答;②根据用燃着的木条放在瓶口,若木条熄灭,则CO2已满解答;根据装置的特点分析解答;(2) ①根据铁的金属活动性比铜强解答;②根据铝丝表面未用砂纸打磨解答;[实验并得出结论]根据金属活动性分析解答;根据铁与硫酸反应生成硫酸亚铁和氢气解答;[反思与评价]根据铁生锈生成氧化铁,氧化铁与盐酸反应生成氯化铁和水解答;[拓展应用]根据各物质的性质分析解答。(1) ①高锰酸钾是固体,反应需要加热,故应选择固体加热型发生装置A,收集较纯净氧气应选择排水法收集,故应选择D装置收集;②选用装置B、C组合在实验室制取CO2,其验满的方法是用燃着的木条放在瓶口,若木条熄灭,则CO2已满;若改用装置F制备CO2,其优点是可控制反应的发生与停止;(2) ①铁的金属活动性比铜强,能置换出硫酸铜溶液中的铜,故B试管中观察到的实验现象有铁丝表面有红色固体析出;②A试管中小雨在很长时间内都未观察到预期的实验现象,其原因可能是铝丝表面未用砂纸打磨,表面有氧化物,阻止铝与硫酸亚铁的反应;[实验并得出结论] 铝的金属活动性比铁强,铁的金属活动性比铜强。过滤,向滤出的不溶性固体滴加足量的稀硫酸,有气泡冒出,则该不溶性固体中一定含有的物质是Fe和Cu ;铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;[反思与评价]氧化铁与盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl=2FeCl3+H2O;[拓展应用] a、NaOH溶液显碱性,与盐酸反应生成氯化钠和水,可以中和过多的盐酸,正确;b、AgNO3溶液能与盐酸反应生成氯化银的白色沉淀和硝酸,硝酸显酸性,错误;c、NaHCO3溶液显碱性,能与盐酸反应生成氯化钠、水和二氧化碳,可以中和过多的盐酸,正确;d、生石灰与水反应生成氢氧化钙,氢氧化钙与盐酸反应生成氯化钙和水,可以中和过多的盐酸,正确;e、石蕊试不与盐酸反应,无法处理至pH=7,错误。故选b、e。
-
科目: 来源: 题型:
查看答案和解析>>【题目】长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分數利用图I装置将足量的盐酸加入到10.0g水垢中。随反应进行,装置C质量的变化如图I所示。请回答:
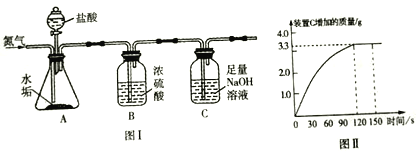
(1)向图I装置A中不断通入氮气的目的是_______________;
(2)若不考虑盐酸的挥发和水垢中含有其他成分,请根据图II数据计算:水垢中碳酸钙的质量是________,水垢中氢氧化镁的质量分数是___________; (不要求计算过程,精确到0.1)
(3)若考虑盐酸的挥发,会造成水垢中碳酸钙质量分数的测量结果_______(填“增大” “减小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像能正确反映对应变化关系的是
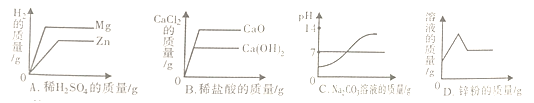
A. 等质量的镁和锌中分别加入等浓度的稀H2SO4至过量
B. 等质量的CaO和Ca(OH)2中分别加入等浓度的稀盐酸至过量
C. CaCl2和HCl的混合溶液中加入Na2CO3溶液至过量
D. AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
-
科目: 来源: 题型:
查看答案和解析>>【题目】请用化学用语回答生活中的下列问题。
(1)新鲜的苹果切开后因亚铁离子被氧化会很快变黄,亚铁离子的符号是_______。
(2)工业盐因含亚硝酸钠(NaNO2)而有毒,标出亚硝酸钠中氮元素的化合价_________。
(3)某学习小组在帮助清理药品时,发现一瓶标签残缺盛有无色溶液(初中化学常用试剂)的试剂瓶 (如下图),你猎想这种试剂可能是___________溶液。

-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下图中甲、乙、丙三种固体的溶解度曲线回答问题。
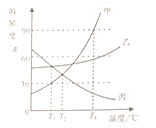
(1)T3℃时,在各加有甲、乙、丙30克固体的三个烧杯中,分别倒入50克水,充分搅拌后,形成饱和溶液的是________________;当温度降低至T1℃时,此三杯溶液中溶质的质量分数由大到小的顺序为__________________。
(2)在T2℃时,将接近饱和的丙物质的溶液变为饱和溶液,下列有关分析正确的是___________(填序号)
①溶质的质量一定不变 ②溶剂的质量可能不变
③溶液的质量一定增大 ④溶液中溶质的质量分数一定增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】某中学化学课外实验兴趣小组欲测定一瓶混有氯化钠的苏打中碳酸钠的质量分数。从该瓶试剂中取出20克样品,放在锥形瓶中加水至全部溶解,再加入稀盐酸,实验相关数据如下图,测得所加稀盐酸质量为m时,瓶中溶液总质量为115.6克。

(1)该瓶苏打中碳酸钠的质量分数是______________;
(2)所加稀盐酸中溶质的质量分数是___________?(写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】t2℃时,向盛有10g水的烧杯中加入13g固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中固体析出,甲的溶解度曲线如图所示。下列说法正确的是

A. 图中P点表示甲的溶解度为98g
B. 搅拌的目的是増大甲的溶解度
C. 通过升温可以将甲的不饱和容易变为饱和溶液
D. 甲溶于水的过程中一定放出热量
相关试题

