【题目】(13分)A、B、C分别是Zn、Cu、Ag三种金属中的一种。为了从它们的混合物中分离
出金属A,并获得B和C的盐,进行如下实验操作:
请回答以下问题:
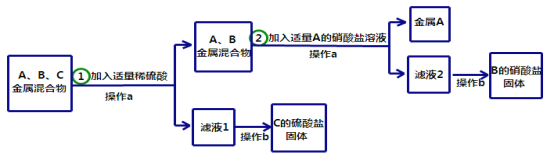
写出步骤①中发生反应的化学方程式 .
A、B、C三种金属的活动性顺序是 > > .
操作b都需要用到玻璃棒的作用是 .
金属A是 (填化学式,下同),B的硝酸盐是 。
把13克的锌投入到98克稀硫酸中恰好完全反应,求生成的氢气的质量是多少?![]()
参考答案:
【答案】(1)Zn + H2SO4 = ZnSO4 + H2↑ (2) C、B、A (3) 防止液体局部受热而飞溅
(4)Ag Cu(NO3)2 (5)0.4g
【解析】
试题分析:(1)根据金属的活动性顺序,三种金属Zn、Cu、Ag,只有锌能与稀硫酸反应,所以步骤①中发生反应的化学方程式:Zn + H2SO4 = ZnSO4 + H2↑,从而可以判断金属C为锌
(2)根据步骤②,在金属Cu、Ag化合物中,加入A的硝酸盐,结果置换出了金属A,所以可判断B为铜,A自然为银,故A、B、C三种金属的活动性顺序是C>B>A
(3)操作b是从溶液中结晶得到固体,故为蒸发,其中用到玻璃棒的作用是:搅拌,防止液体局部受热而飞溅
(4)根据上面的分析件数A为银,化学式为:Ag,B的硝酸盐是通过铜和硝酸银溶液反应得到,故为硝酸铜,化学式为:Cu(NO3)2
(5)根据化学反应方程式:Zn + H2SO4 = ZnSO4 + H2↑中锌与氢气的质量关系,即可求出氢气的质量
解:设氢气的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
2
13g x
65:2=13g:x
X=0.4g
-
科目: 来源: 题型:
查看答案和解析>>【题目】近年来因假酒造成的中毒事件在我国时有发生.有些假酒是用工业酒精勾兑而成,这样的假酒中所含的有毒物质是 ( )
A. 水 B. 甲醇 C. 乙醇 D. 碳酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】(8分)碳元素是组成许多物质的基本元素。
(1)下列含碳元素的物质中,属于有机物的是 (填字母序号)。
A.碳酸钙 B.乙醇(C2H5OH ) C.二氧化碳
(2)化石燃料主要包括煤、 和天然气,它们都含有碳元素,其中天然气的主要成分
是 (写化学式)。
(3)很多天然矿石中含有碳元素,菱锰矿的主要成分是碳酸锰(MnCO3),其中锰元素的化合价 。
(4)在 440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为 。
(5)“碳海绵”是已知最轻的固体材料(如下图所示),由碳元素组成,具有多孔结构,弹性好。它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。下列关于碳海绵的说法正确的是 (填字母序号)。

A.具有吸附性 B.可重复使用 C.可处理海上石油泄漏
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列饮料中,不属于溶液的是( )
A、汽水 B、啤酒 C、矿泉水 D、酸奶
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )
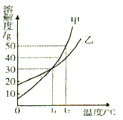
A.t2℃时,在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等
B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙
C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时.将甲、乙饱和溶液降温至tl℃,甲溶液析出晶体的质量大于乙
-
科目: 来源: 题型:
查看答案和解析>>【题目】柠檬是一种营养极高的水果,因为含有丰富的柠檬酸,被誉为“柠檬酸仓库”,将柠檬切成薄薄的片泡在温开水中,有利于保存柠檬中的营养物质。柠檬酸是一种重要的有机酸,下列关于柠檬酸的叙述错误的是( )
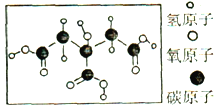
A.每个柠檬酸分子中含有个碳原于8氢原子、7个氧原子
B.柠檬酸能使酚酞溶液由无色变红色
C.柠檬酸中的的氧元素的质量分数最高
D .向水中加入适量的白糖、果汁、柠檬酸的小苏打,可以制汽水
-
科目: 来源: 题型:
查看答案和解析>>【题目】白醋(主要成分是醋酸)和白酒是生活中常见的两种物质,请你利用它们的化学性质的不同,设计一种简单的方法来鉴别它们.
相关试题

