【题目】小红以家里的黄铜(铜锌合金)为材料自制胆矾(硫酸铜晶体),制备流程如下:
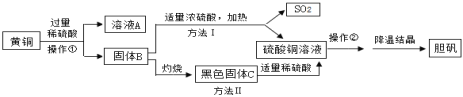
(1)操作①得到的固体B还需要洗涤,洗涤的作用是___________。
(2)溶液A的溶质有______。灼烧固体B的化学方程式为_______。
(3)黑色固体C与稀硫酸反应的化学方程式为__________。
(4)制备流程中操作②的名称是______,进行该操作时会使用到玻璃棒,其作用是________。
(5)两种方法比较,方法Ⅱ更符合绿色化学的要求,理由是_______。
参考答案:
【答案】除去固体上附着的硫酸锌和硫酸 H2SO4 、ZnSO4 2Cu+O2![]() 2CuO 加热浓缩 防止受热不均而液滴飞溅 CuO+H2SO4=CuSO4+H2O 方法Ⅰ生成了SO2,会污染空气
2CuO 加热浓缩 防止受热不均而液滴飞溅 CuO+H2SO4=CuSO4+H2O 方法Ⅰ生成了SO2,会污染空气
【解析】
(1)操作①得到的固体铜还需要洗涤,洗涤的作用是除去固体上附着的硫酸锌和硫酸;
(2)溶液A的溶质有反应生成的硫酸锌和过量的硫酸;灼烧固体铜的化学方程式为:2Cu+O2![]() 2CuO;
2CuO;
(3)黑色固体氧化铜与稀硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O;
(4)制备流程中操作②的名称是加热浓缩,进行该操作时会使用到玻璃棒,其作用是防止液体受热不均而导致液滴飞溅;
(5)两种方法比较,方法Ⅱ更符合绿色化学的要求,理由是:方法Ⅰ生成了二氧化硫,会污染空气,而方法Ⅱ不产生污染环境的二氧化硫。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
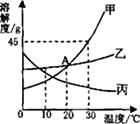
(1)A点的含义是______________。
(2)在30℃时,向30g甲物质中加入50g水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下图回答问题:
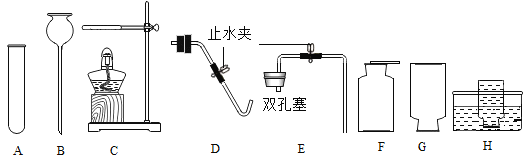
(1)仪器B的名称是__________。
(2)用KClO3与MnO2混合加热制取和收集纯净O2,应选用上图中的_____(填序号),反应的化学方程式____________________________ ,实验结束后,经过______、过滤、洗涤、_______等操作回收纯净的二氧化锰。
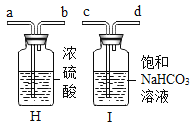
(3)实验室制取和收集CO2,应选用上图中的______(填序号),反应的化学方程式______;采用这种方法制取的二氧化碳中常含有氯化氢气体和水蒸气。为获得纯净、干燥的二氧化碳气体,可选用如图所示的H装置和I装置进行除杂和干燥,导管口连接的正确顺序是:气体→(_________)→(_________)→(_________)→(_________)→F。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图,A~H是初中化学常见的物质,A是人体胃液中含有的成分,A和B可发生中和反应, C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂,Y为单质,根据图示回答问题:

(1)写出H、Y的化学式: H________; Y_________。
(2)写出A+B→C+D的反应方程式:___________。反应②的化学方程式为:__________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。下图分别为两种补钙剂说明书的一部分。
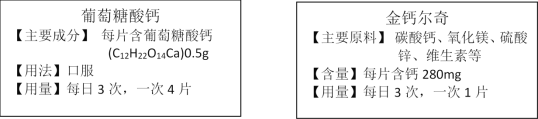
请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足量的钙,才能避免_______(填字母序号);
A.佝偻病或骨质疏松 B.贫血症 C.甲状腺肿大
(2)葡萄糖酸钙(C12H22O14Ca)的相对分子质量是____________;
(3)碳酸钙(化学式为CaCO3)中钙元素的质量分数为______________;
(4)每片金钙尔奇中含碳酸钙的质量为________mg;
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
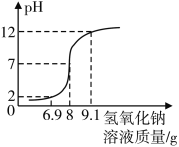
步骤一:配制溶质质量分数为10%的氢氧化钠溶液。
步骤二:向20 g待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图象如图。
(1)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的pH达到2时,溶液中的溶质有___。(用化学式表示)
(2)请结合图,计算该稀盐酸的溶质质量分数__________。(结果精确到0.01%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关化学用语表示不正确的是( )
A. 2个铝离子:2Al3+ B. 氧分子:O
C. 钠原子的结构示意图:
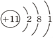 D. 氧化镁中镁元素显+2价:
D. 氧化镁中镁元素显+2价: 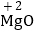
相关试题

