【题目】小明在协助老师清理实验储备室时,发现一瓶存放多年的氢氧化钙,为检验其变质情况,进行如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,然后逐滴滴加14.6%的稀盐酸,加入稀盐酸的质量与锥形瓶中物质的质量关系如下表所示,请问:
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
锥形瓶中物质的质量/g | 60 | 70 | 80 | 90 | 100 | 109.12 | 118.24 | 128.24 |
(1)氢氧化钙变质的原因是 (用化学方程式表示)。
(2)与氢氧化钙反应的稀盐酸溶液的质量为 g。
(3)计算11.4g该样品中氢氧化钙的质量分数(写出计算过程,结果精确到0.1%)。
(4)根据计算所得数据画出生成CO2的质量的曲线。
参考答案:
【答案】(1)Ca(OH)2+CO2=CaCO3↓+H2O;(2)50;(3)64.9%;(4)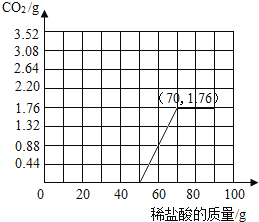
【解析】(1)氢氧化钙属于碱,易与空气中CO2反应生成碳酸钙和水,其变质时发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;
(2)在添加稀盐酸50g~60g时生成CO2的质量为60g+50g-109.12g=0.88g;在添加稀盐酸60g~70g时生成CO2的质量为70g+50g-118.24g=1.76g;在此基础上继续滴加稀盐酸,无CO2生成,则说明与碳酸钙反应的稀盐酸是20g,与氢氧化钙反应的稀盐酸溶液的质量为50g;
(3)设10g稀盐酸中HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x 0.88g
![]() =
=![]() ,解得:x=1.46g,
,解得:x=1.46g,
设11.4g样品中氢氧化钙的质量为y,
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
y 1.46g×50
![]() =
=![]() ,解得:y=7.4g;
,解得:y=7.4g;
11.4g该样品中氢氧化钙的质量分数为![]() ×100%=64.9%。
×100%=64.9%。
(4)由图表可知,滴加50g稀盐酸后继续滴加有CO2生成,滴加稀盐酸至70g时CO2生成量为1.76g,继续滴加无CO2生成,所得图表为: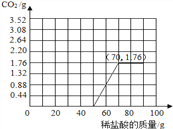 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下列实验常用装置,回答有关问题.
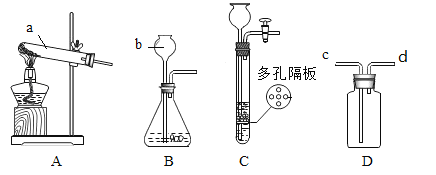
(1)写出图中标有字母的仪器名称:a_______,b_______。
(2)若用氯酸钾制取氧气,应选用的发生装置是__________(填“A”、“B”或“C”),装入药品前应先_______,反应的化学方程式是___________________________。
(3)实验室用B装置制取CO2,B中装有石灰石,那么a中应加入______(填名称)。其化学反应方程式为:__________________。如果用D装置收集氢气,则气体从___端进入(填“c”或“d”)。
(4)实验室如用块状固体和液体无需加热制取气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其优点是________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是常见的物质之一,是生产生活中必不可少的物质,请回答下列问题:
(1)天然水中含有许多杂质,实验室常用过滤方法除去水中不溶性杂质,过滤需要用到的仪器有带铁圈的铁架台、烧杯、漏斗和________(填玻璃仪器名称)。
(2)酸碱度过大或硬度过大的水都不宜饮用,实验室可用_________测定水的酸碱度。
(3)氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为:
MnO2+4HCl(浓)
 X+Cl2↑+2H2O,X的化学式为____________。
X+Cl2↑+2H2O,X的化学式为____________。(4)在电解水的实验中,涉及到的化学反应方程式:________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一无焰野外加热器,由镁和水反应产生热量来进行加热,化学方程式为Mg+2H2O=Mg(OH) 2+H2↑。该反应属于( )
A. 化合反应 B. 分解反应
C. 复分解反应 D. 置换反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中不正确的是( )
A. 分子、原子、离子都可以构成物质
B. 原子是化学反应中的最小粒子
C. 同种元素组成的物质一定是单质
D. “热胀冷缩”现象表明分子间有间隔
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列四个图像分别表示对应的四个操作过程,其中与事实不相吻合的是:
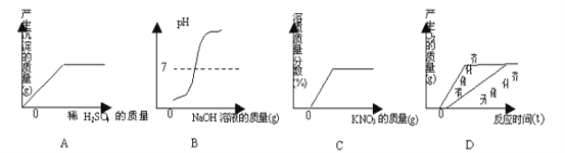
A. 一定量Ba(NO3)2 溶液中滴加稀H2SO4
B. 一定量稀盐酸中滴加NaOH溶液
C. 一定量不饱和KNO3溶液中加固体KNO3
D. 质量相同的KClO3中加入催化剂(MnO2)与不加入催化剂加热制取O2
-
科目: 来源: 题型:
查看答案和解析>>【题目】用适当的化学符号或数字填空:
(1)硝酸铵的阴离子_________
(2)
 所表示的微粒符号是_________
所表示的微粒符号是_________(3)5个三氧化硫分子____________
(4)分析KClO3中氯酸根的构成和化合价,写出氯酸钙的化学式_________________
相关试题

