【题目】为判断某有机物的元素组成,其相对分子质量为46,取该某有机物4.6克,在足量的氧气中充分燃烧,生成8.8克二氧化碳和5.4克水,据此判断该有机物中有____________元素,且该有机物的化学式是 _________。
参考答案:
【答案】 C、H、O元素 C2H5OH 或C2H6O
【解析】一种物质燃烧只生成水和二氧化碳,则该物质肯定含有碳和氢元素.是否含氧则可根据质量守恒定律由下法确定:
8.8g二氧化碳中含氧元素的质量为:8.8g×![]() ×100%=6.4g,含碳元素的质量为:8.8g-6.4g=2.4g;
×100%=6.4g,含碳元素的质量为:8.8g-6.4g=2.4g;
5.4g水中含氧元素的质量为:5.4g×![]() ×100% =4.8g,含氢元素的质量为:5.4g-4.8g=0.6g;
×100% =4.8g,含氢元素的质量为:5.4g-4.8g=0.6g;
则4.6g某纯净物中含氧的质量为:4.6g-2.4g-0.6g=1.6g;
某纯净物中原子个数比为C:H:O= ![]() =2:6:1;
=2:6:1;
又相对分子质量为46,所以该物质的化学是为:C2H6O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是实验室常用的仪器。
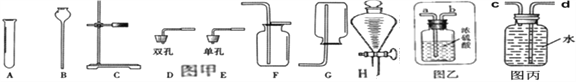
(1)写出指定仪器的名称:A _____________ ,B__________
(2)若要组装一套二氧化碳的发生和收集装置,可选择图甲中的___________(填字母标号)。
实验室制取二氧化碳的化学方程式为_________________________。
若要干燥该二氧化碳气体,气体应该从图乙中_____进。(填“a”或“b”)
(3)用该装置还可以制取的气体是________,实验室制取该气体的化学方程式为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组物质中,化学性质彼此多处相似的是
A、CO、CO2 B、C、CO2 C、C、CO D、O2、CO
-
科目: 来源: 题型:
查看答案和解析>>【题目】兴趣小组想测定某铁合金中铁的含量,做了如下实验,称取14克样品,放入质量为50克的烧杯中,再往烧杯中加入100克足量的稀硫酸(杂质碳不与酸反应,也不溶于水),
并对烧杯进行了四次称量,记录数据如下:
反应时间
T0
T1
T2
T3
烧杯总质量(克)
164
163.8
163.6
163.6
求(1)反应产生的氢气的质量是多少?
(2)该样品中铁的质量分数是多少?
(3)反应后所得溶液中溶质质量分数是多少?(要求写出计算过程,结果精确到0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是固体物质M的溶解度曲线,下列说法正确的是

A. 40℃时,其饱和溶液中溶质的质量分数为50%
B. M的溶解度随温度升高而一直增大
C. 将40℃是M的饱和溶液降温至10℃,有固体析出
D. 将50℃时M的饱和溶液升温至80℃,溶液变为不饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降。Na2S2O4制备流程如下:(已知:常温下Zn(OH)2的溶解度为1.42×105g)
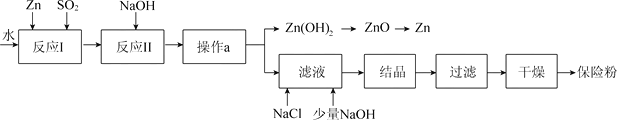
(1)反应I的原理为:Zn+2SO2===ZnS2O4,该反应的基本类型为___________。
(2)反应II为复分解反应,该反应的化学方程式为_________________________________。
(3)操作a的名称为__________。
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出加入NaCl的原因是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于原子、分子、离子的认识不正确的是
A. 水、氯化钠、铜都是由分子构成的 B. 化学变化中分子可分,原子不可分
C. 分子、原子都在不停运动 D. 离子带电,分子、原子不显电性
相关试题

