【题目】室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到100g硫酸铜溶液中。
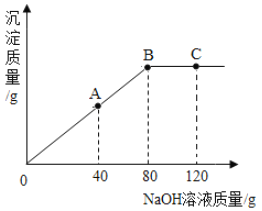
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含的溶质为(写化学式)_____。
②该反应过程中,观察到的一个明显反应现象是_____。
③当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液的质量_____(计算结果精确到0.1g)。
【答案】CuSO4、Na2SO4 生成蓝色沉淀 170.2g
【解析】
①当滴入氢氧化钠溶液40g时(即图中A点),此时硫酸铜尚未完全反应,所以烧杯中溶液里含的溶质为剩余的硫酸铜和生成的硫酸钠,对应的化学式为 CuSO4、Na2SO4。
②该反应过程中,观察到的一个明显反应现象是 生成蓝色沉淀。
③当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,此时消耗的氢氧化钠的质量为10%×80g=8g
设生成的氢氧化铜的质量为y
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
80 98
8g y
![]() =
=![]()
y=9.8g
此时所得不饱和溶液的质量100g+80g﹣9.8g=170.2g。

