【题目】氯化钠和氯化镁是重要的化工原料.某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案:
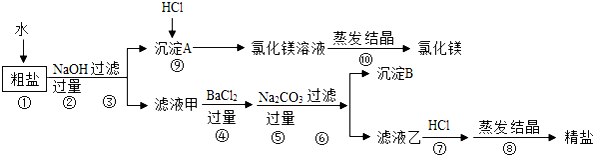
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是 .
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是 .
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有 ;
沉淀B中除含碳酸钙、碳酸钡外还含有 ;
在步骤⑦中若加入的盐酸略过量是否对实验结果有影响? 原因是 .
Ⅳ.写出步骤⑨中反应的化学方程式 .属于 反应(填基本反应类型)。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有 个.
参考答案:
【答案】Ⅰ 加速溶解 Ⅱ 精盐中会混有氯化钡
Ⅲ 碳酸钠和氢氧化钠 硫酸钡 无影响,因为蒸发时氯化氢气体挥发掉
Ⅳ Mg(OH)2+2HCl=MgCl2+2H2O 复分解反应;Ⅴ 6
【解析】
试题分析:Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是加速溶解Ⅱ.步骤⑤的顺序颠倒会引发的后果是过量的氯化钡会混入精盐中,Ⅲ.滤液乙中所含的溶质除氯化钠外还含有加入的过量的碳酸钠和氢氧化钠;还含有氯化钡与硫酸钠反应生成的硫酸钡沉淀;因为盐酸有挥发性,加热蒸发时氯化氢气体挥发掉;沉淀A是氢氧化钠与氯化镁反应产生的沉淀氢氧化镁,滴加盐酸反应为Mg(OH)2+2HCl=MgCl2+2H2O
考: 化学实验探究。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钠是一种重要的碱,同学们对它进行了如下探究:
①探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
设计方案如下,请思考每个方案是否正确。
实验步骤
实验现象预测
结论
方案一
取少量反应后的溶液于一支试管中,并滴加几滴无色
酚酞试液,振荡
酚酞试液不变色
恰好完全中和
方案二
用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,与标准比色卡对照
pH=7
恰好完全中和
方案三
取少量反应后的溶液于一支试管中,并滴加稀硝酸和
硝酸银溶液
有白色沉淀产生
盐酸过量,没
有完全中和
经过讨论,一致认为只有方案二是正确的,请写出该中和反应的化学方程式 (12) ;
请分析方案一错误的原因: (13) ;
请用化学方程式表示方案三错误的原因 (14) 。
②探究二:一瓶久置的氢氧化钠固体的成分是什么?
请你将实验报告填写完整:(已知氯化钡溶液显中性)
实验步骤
实验现象
实验结论
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加足量的氯化钡溶液
有白色沉淀产生
样品中含有 (15)
此过程中发生反应的化学方程式是 (16)
步骤二:取步骤一试管中少量上层清液,滴加无色酚酞
酚酞变红色
样品中含有 (17)
通过实验,判定该久置氢氧化钠固体的成分是 (18) 。
-
科目: 来源: 题型:
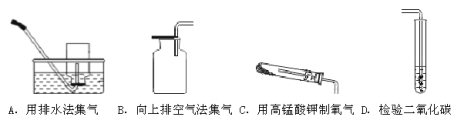
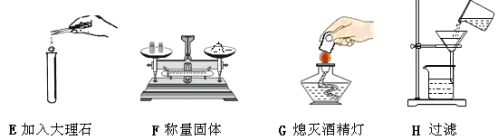
查看答案和解析>>【题目】(1)下列A——D图示是有关玻璃导气管的使用(省略夹持和加热装置),E——H是实验基本操作,其中A——H中,正确的是
(2)某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:①溶液甲中一定含有Al(NO3)3和Zn(NO3)2;

②固体乙中一定含有Ag,可能含有Cu和Zn;
③若溶液甲是蓝色,则溶液甲一定含Al(NO3)3、Zn(NO3)2和Cu(NO3)2;
④向固体乙滴加稀盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2。
上述四种说法中正确的 (填序号)
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类的生存和发展离不开能源和资源。
(1)家用燃料的更新过程如下:煤→液化石油气或管道煤气→天然气,下列有关家用燃料更新的理由,正确的是 (选填字母)。
A.天然气属于可再生能源 B.气体燃料比固体燃料利用率更高
C.天然气作为燃料可避免温室效应的发生 D.煤仅仅用作燃料烧掉浪费资源
(2)水是生命之源,合理利用和保护水资源是我们义不容辞的责任。
①硬水有害健康,生活中可以通过 的方法使硬水软化成软水。
②公共场所可利用“活性炭+超滤膜+紫外线”组合工艺获得直饮水,其中活性炭主要起 作用。
③保护水资源人人有责。请列举一条节约用水的措施: 。
(3)人类每年都要从大自然中提取大量的金属,用于满足日常生活和工农业生产的需要。钢铁是我们日常生活中使用最多的金属材料。高炉炼铁常以焦炭、铁矿石、石灰石等为原料,炼铁过程中,一氧化碳和赤铁矿(主要成分为Fe2O3)反应的化学方程式为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验基本操作在化学学习中具有重要作用.现有a试管、b漏斗、c酒精灯、d集气瓶、e药匙、f胶头滴管等仪器,请为下列实验操作各选一种(用序号填空).
(1)可以直接在酒精灯上加热的仪器是 ;
(2)吸取或滴加少量液体使用 ;
(3)取用粉末状固体药品应用 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某同学设计下图探究二氧化碳气体在水中的溶解能力:
实验步骤及装置如图:

①用大号针筒抽取200mL二氧化碳气体;②试剂瓶中加 入200mL水(恰好加满),塞紧双孔橡皮塞;③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中;
当向水中注入CO2气体体积达到120mL时,红色油柱开始向上移动,实验表明在该条件下,1体积水中能溶解 体积二氧化碳,要提高二氧化碳在水中的溶解能力,可采取的一种措施是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】
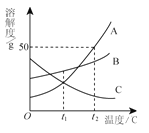
A. t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
B. t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1∶3
C. 将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D. 将C的饱和溶液变为不饱和溶液,可采用升温的方法
相关试题

