【题目】某学习小组利用如图所示实验装置研究影响金属与硫酸反应速率的因素。
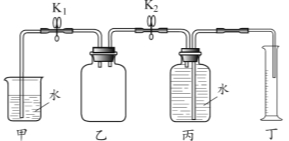
步骤如下:
① 关闭K2、打开K1,检查乙装置气密性,向乙中加入锌粒和稀硫酸,塞紧胶塞。
② 待气泡连续均匀产生,关闭K1、打开K2,并开始计时。
③ 待丁中收集到10 mL水,结束计时。
④ 换不同溶质质量分数、不同体积的硫酸,与质量相同的同一种锌粒重复实验。
每次实验的数据记录如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 |
硫酸用量/mL | 10 | 20 | 40 | 10 | 20 | 40 |
硫酸的溶质质量分数/% | 10 | 10 | 10 | 20 | 20 | 20 |
收集所用时间/s | 106 | 102 | 97 | 45 | 41 | 40 |
(1)乙中发生反应的化学方程式为 。
(2)检查乙装置气密性的方法是 。
(3)通过比较实验_____________________(填数字)的数据可以得出,对金属与硫酸反应速率有显著影响的是 。
参考答案:
【答案】(1)Zn + H2SO4=ZnSO4 + H2↑(2)将左导管插入甲中,用手握住乙装置集气瓶的外壁,若甲中有气泡冒出,松手后导管口出现一段水柱,则装置气密性良好(3)1、2和1、4(其它合理答案均给分)硫酸的溶质质量分数
【解析】
试题分析:(1)锌与稀硫酸反应生成的是硫酸锌和氢气:Zn + H2SO4=ZnSO4 + H2↑;
(2)关闭K2、打开K1,将左导管插入甲中,用手握住乙装置集气瓶的外壁,若甲中有气泡冒出,松手后导管口出现一段水柱,则装置气密性良好;
(3)由实验数据,对比1和4可知等质量不同浓度的稀硫酸,稀硫酸的浓度越大,反应速率越快;对比1和2,可知相同浓度、不同体积的稀硫酸,稀硫酸的体积越大,反应速率越快。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作中正确的是
A.尝药品的味道 B.用剩的药品放入指定的回收容器中
C.量筒用作反应器 D.加热试管中的液体时试管口对着他人
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于复合肥料的是
A. NaNO3 B. K2SO4 C. NH4H2PO4 D. Ca3(PO4)2
-
科目: 来源: 题型:
查看答案和解析>>【题目】 下列有关课外实验的说法不正确的是
A.加入熟石灰并研磨,可区分氯化铵和硫酸铵
B.在靠近蜡烛火焰的上方放一只冷碟子,一段时间后可收集到炭黑
C.用灼烧并闻气味的方法,可区分羊毛纤维和棉纤维
D.在制作叶脉书签时,一般选用10%的氢氧化钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】在研究人呼出的气体与空气中二氧化碳有什么不同时,实验小组曾用排水法收集一瓶气体与空气进行对比实验(如右图)。对比实验中看到的现象是__________,反应的化学方程式为____________。

【提出问题】实验室制取二氧化碳时能不能用排水法收集?
【查阅资料】通常情况下:二氧化碳在饱和碳酸氢钠溶液中
不溶;1体积水约能溶解1体积二氧化碳。
【进行实验】实验小组设计了如下图实验装置进行探究。
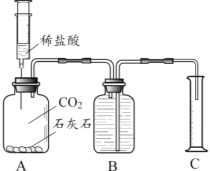

(1)A中发生反应的化学方程式为 。
(2)A中充满二氧化碳的目的是 。
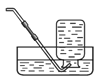
(3)实验室用排水法收集气体的方法通常如右图所示,则实验小组的研究中,实验装置B还有缺陷,你认为改进的方法是 。
(4)改进装置后,再次按照实验1和2的过程进行实验,实验结果为“量筒内液体体积,实验2比实验1少约10%”,说明二氧化碳可以用排水法进行收集。你认为二氧化碳能用排水法收集的原因是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、Z三种物质的溶解度曲线如右图所示。下列叙述中,正确的是
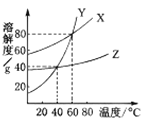
A.40℃时Z的溶解度最大
B.三种物质的饱和溶液,温度由60℃降至40℃时,Y析出的晶体最多
C.40℃时,Z和Y的饱和溶液的溶质质量分数相同
D.40℃时,X、Y、Z的饱和溶液升温至60℃,溶质质量分数X=Y>Z
-
科目: 来源: 题型:
查看答案和解析>>【题目】 在受到猛烈撞击时,汽车安全气囊内的物质迅速分解,产生大量的气体,该气体就是空气中体积分数最大的气体。该气体是
A.氮气 B.氧气 C.氦气 D.水蒸气
相关试题

