【题目】盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。

(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
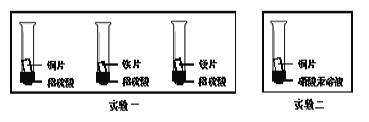
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A. 滤纸上一定有Fe,可能有Mg、Cu
B. 滤纸上一定有Cu,可能有Fe,一定没有Mg
C. 滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D. 滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组 | 第Ⅱ组 | 第Ⅲ组 | |
稀硫酸的质量/g | 50 | 100 | 150 |
溶解固体的质量/g | 10.0 | 16.0 | 16.0 |
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
 ___________________
___________________
参考答案:
【答案】 A 合成 O2\H2O 洗净擦干(合理即可) 镁与稀硫酸反应产生气泡的速率快 Cu的活动性比Hg强 B D 稀硫酸 80% 24.5% 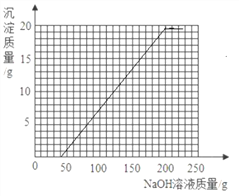
【解析】(1)铁锅主要利用金属具有良好导热性;铜导线主要利用了金属的延性和导电性;铝箔主要利用了金属的展性;铁锤主要利用金属的硬度、强度大的性质;聚乙烯属于塑料的一类,属于有机高分子合成材料;(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的氧气、水共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是用完后及时擦干;(3) 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。判断出镁的金属活动性比铁强,依据的现象是镁与稀硫酸反应产生气泡的速率比铁快;实验二的现象是铜的表面有银白色固体生成,溶液由无色变成蓝色,说明铜能与硝酸汞反应,应得出的结论是Cu的活动性比Hg强;(4)向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,镁先与硫酸铜反应,然后再与硫酸亚铁反应。充分反应后过滤,滤液呈浅绿色,说明硫酸亚铁有剩余、镁粉一定完全反应;再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,说明硝酸铜完全反应。故反应后溶液中的溶质有剩余的硫酸亚铁和生成的硫酸镁;固体中一定有铜,可能有铁;选BD;(1)由题中的数据分析可知,20g样品中含氧化铜的质量16g,样品中氧化铜的质量分数:16g÷20g×10%=80%;由题中数据分析知,10g氧化铜一定能将50稀硫酸中的溶质完全反应。
(2)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
8098
10g50gx
80/10g=98/50gx
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(3)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO + H2SO4 ═ CuSO4+H2O
80 98 160
16g 24.5%y z
80/98=16g/24.5%y y=80g
80/160=16g/z z=32g z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4 + 2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
![]()
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应,再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
160 80 98
32g10%n w
![]()
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如下图.
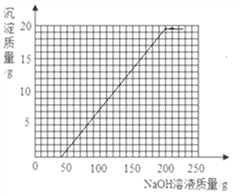
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)用适当的数字和符号填空:
①二个钠离子_____; ②三个氢氧根离子_____;③硝酸铵中显﹣3价的氮元素___________;
(2)选择适当物质的序号填空。
A.二氧化碳 B.小苏打 C.硝酸钾 D.氮气 E.熟石灰 F.聚乙烯
①可用于人工降雨的是____________; ②农业上可作复合肥的是______________;
③可用于食品膨松剂的是__________; ④常用于保护蔬菜瓜果的气体是_________;
⑤用作食品包装材料的____________; ⑥可用作改良酸性土壤的是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】食品与健康、能源与环境是我们共同关注的社会问题.
(1)紫薯营养丰富,具有特殊的保健功能。紫薯中富含淀粉、维生素C、维生素B、铁、钙、硒等。
①这里的“铁”、“钙”是指_________(填字母序号)
A.原子 B.分子 C.元素 D.单质
②人体缺“铁”,会导_________病症;③紫薯中能给人体提供能量的物质是__________;
(2)天然气是汽车使用的燃料之一,其主要成分燃烧反应的化学方程式是_____________ 。
(3)二氧化碳是造成温室效应的主要气体,从“低碳”的角度分析,应尽量减少二氧化碳的排放。
①在氢气、煤、石油中,最理想的燃料是___________;
②将排放出的二氧化碳吸收并转化为可再利用的物质是科学家研究的方向。检验吸收后的气体中是否含有二氧化碳,依据反应的化学方程式是_____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。

(1)检验装置B的气密性操作:______________________________。
(2)若选用装置B作为制取氧气的发生装置,设计装置B时使用仪器d的目的是_________,写出发生反应的化学方程式__________________。如要收集干燥的氧气,则需要A装置,作用是___________。
(3)若以石灰石和稀盐酸为原料,在实验室中制取并收集干燥、纯净的二氧化碳气体,写出反应的化学方程式___________,所需仪器的连接顺序为____________(从左至右填写仪器序号字母)。
(4)实验室常用加热无水醋酸钠和碱石灰两种固体的方法制取甲烷气体,通常情况下,甲烷是没有颜色、没有气味的气体,比空气轻,极难溶于水。若要制取一瓶甲烷,可选用的装置有___________(填写仪器序号字母)。如果选用F装置收集甲烷,气体应从_______(填“a”或“b”)端管口通入。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语与所表达的意义相符的是( )
A. N2 — 2个氮原子 B. Mg2+ —镁元素的化合价为+2价
C. 2H — 2个氢原子 D.
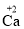 — 1个钙离子带2个单位的正电荷
— 1个钙离子带2个单位的正电荷 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像能正确反映其对应的实验操作的是

A.一定温度下,向饱和的硝酸钾溶液中不断加入硝酸钾固体
B.等质量的高锰酸钾和氯酸钾分解制氧气
C.向等质量的镁粉和铁粉中缓慢地逐滴加入稀硫酸
D.碳酸钠和稀盐酸在烧杯中反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】a、b、c三种物质的溶解度曲线如图所示。
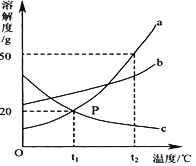
(1)交点P的含义为_____________________。
(2)t1℃时,将45g a物质投入200g水中,充分溶解后形成的溶液溶质质量分数为__________。
(3)t2℃时,将a、b、c三种物质的饱和溶液分别降温至t1℃,此时三种物质的溶液溶质质量分数从大到小的顺序为_____________。
(4)甲图烧杯A中是20℃时硝酸钾的饱和溶液,乙图是硝酸钾的溶解度曲线,M、N分别表示硝酸钾溶液的两种状态。下列做法能实现M转化为N的是___________(填序号)。
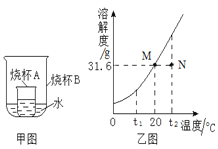
①向烧杯A中加硝酸钾固体
②向烧杯A中加一定量的水
③向烧杯B中加一定量的浓硫酸
④向烧杯B中加一定量的硝酸铵固体
相关试题

