【题目】Ⅰ.下列是实验室制取气体的一些装置图,请根据要求回答:
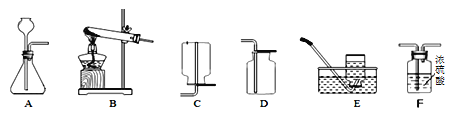
(1)实验室用高锰酸钾做原料制氧气的化学方程式为____________,可选用的发生装置是_______________(填字母序号)。
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为______________。按照气流自左至右方向流动,所用仪器按连接顺序依次为______________(填字母顺序)。
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气。要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)________mL(计算结果保留一位小数)。稀释过氧化氢溶液的主要步骤有:计算、_____________、稀释、装瓶并贴标签。
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:

(1)上述实验设计中有错误的是_____________(填字母序号),A中可燃物应取过量的原因是___________。
(2)B中玻璃棒搅拌的目的是_____________,C中会出现的实验现象为______________。
(3)D中硬质玻璃管内发生反应的化学方程式为________________,酒精灯的作用是_________。
参考答案:
【答案】 2KMnO4![]() K2MnO4+ MnO2+ O2↑ B CaCO3+2HCl== CaCl2+H2O+ CO2↑ AFD 90.9mL 量取 AB 将广口瓶内氧气全部耗尽 散热 U型管内液面a高b低 略 消除尾气
K2MnO4+ MnO2+ O2↑ B CaCO3+2HCl== CaCl2+H2O+ CO2↑ AFD 90.9mL 量取 AB 将广口瓶内氧气全部耗尽 散热 U型管内液面a高b低 略 消除尾气
【解析】(1)高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气,化学方程式为2KMnO4![]() K2MnO4+ MnO2+ O2↑;(2). 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(1) 上述实验设计中有错误的是AB测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(2)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(3)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3高温2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;
K2MnO4+ MnO2+ O2↑;(2). 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(1) 上述实验设计中有错误的是AB测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(2)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(3)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3高温2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;
-
科目: 来源: 题型:
查看答案和解析>>【题目】N(NO2)3是科学家近年来新发现的一种新型火箭推进剂的原料.下列有关说法正确的是( )
A.N(NO2)3由三种元素组成
B.N(NO2)3属于有机物
C.N(NO2)3的相对分子质量152
D.N(NO2)3中氮元素的质量分数为18.4%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化中,属于化学变化的是
A、酒精挥发 B、矿石粉碎 C、冰雪融化 D、钢铁生锈
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于过滤操作的叙述不正确的是
A.滤纸的边缘要低于漏斗口 B.液面不要低于滤纸的边缘
C.玻璃棒要靠在三层滤纸的一边 D.漏斗下端的管口要紧靠烧杯的内壁
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的
是____________(填数字序号)。
① 食盐和水 ② 氯化钠溶液和硝酸钾溶液 ③ 铁和氯化铜溶液
(2)某反应的微观示意图如下图所示:
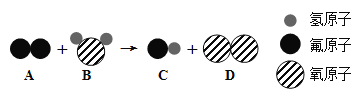
① A的化学式为_________。
② 该反应所属的基本反应类型为___________________反应。
③ 参加反应的A物质和生成的C物质分子数目比为____________________。
Ⅱ.甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如右图所示:
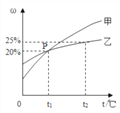
(1)甲和乙两种物质的溶解度随温度的升高而___________(填“增大”或“减小”)。
(2)下列对P点的含义叙述正确的是_____________(填字母序号)。
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(3)25 g乙物质完全溶于100g水中所需的最低温度是________℃。
(4)t2℃时,若甲和乙两种物质的饱和溶液中析出等量的固体须蒸发掉较多水的是_________(填“甲”或“乙”)物质饱和溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
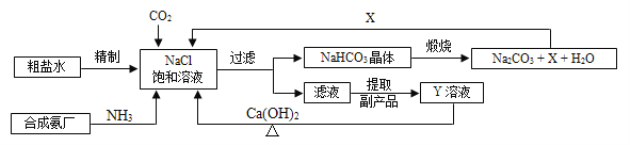
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的① NaOH溶液、② Na2CO3溶液、③ BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为_____________(填字母序号)。
A.①②③ B.③②① C.①③②
(2)加盐酸的作用是(用方程式表示)________________、______________。
(3)制碱原理可看作是由① CO2 + NH3 + H2O = NH4HCO3和② NaCl + NH4HCO3 = NaHCO3+ NH4Cl两个反应加合而成。反应②为复分解反应,请根据复分解反应发生的条件及表1中相关物质20℃时的溶解度,分析反应②为何能顺利进行?_______________。
表1 相关物质的溶解度(20℃)(单位:g)
NaCl
NH4HCO3
NaHCO3
NH4Cl
36.0
21.7
9.6
37.2
(4)操作2为洗涤、煅烧。晶体应在以下装置______________中(填字母序号)进行“洗涤”操作。

在上述操作中,如何判断晶体已经洗涤干净______________。
(5)X的化学式为_____________,若X直接排放到空气中会造成的后果是_______________。
(6)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为______________,Y的化学式为______________,写出Y的一种用途_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用分子的观点解释下列现象,错误的是
A、热胀冷缩——分子大小随温度变化而变化
B、花香四溢——分子不停地运动
C、冰融化成水——分子间的间隔发生变化
D、食物腐败——分子发生变化
相关试题

