【题目】某化学活动小组合作学习氢氧化钠和氢氧化钙的相关知识。
[活动1]下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |

(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,右图中能表示NaOH溶解度曲线的是_________(填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入氢氧化钙A B②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。其中措施正确的是_______(填字母);
A、②④⑥ B、③④ C、①③⑤⑥ D、①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体。这时溶液的质量分数为____________;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量乙_______(填“>”或“<”“=”)甲;
[活动2]20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_________________(填“偏大”或“偏小”“不受影响”)。
[活动3]用化学方法鉴别氢氧化钠溶液和澄清石灰水实验方案为___________。
参考答案:
【答案】A D 47.6% < 偏小 合理即可
【解析】
本题考查了溶解度概念和溶解度曲线,饱和溶液和不饱和溶液相互转变的方法,溶液酸碱度的测定,常见碱的鉴别等。
(1)NaOH的溶解度随温度的升高而增大,所以右图中A能表示NaOH溶解度曲线;
(2)①加入氢氧化钙,能使不饱和溶液变为饱和溶液;②升高温度,氢氧化钙的溶解度减小,可以由不饱和溶液变为饱和溶液;③降低温度,氢氧化钙的溶解度增大,不能变为饱和溶液;④加入水,不能变为饱和溶液;⑤蒸发水后再恢复到原温度,可以由不饱和溶液变为饱和溶液;⑥加入生石灰,则氧化钙和水反应生成氢氧化钙,会使溶液变为饱和溶液。措施正确的是①②⑤⑥,故选D;
(2)20℃时NaOH的溶解度是91g,则10g水中最多溶解9.1g,所以191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体9.1g,此时溶液的质量分数=![]() ×100%=47.6%;
×100%=47.6%;
(3)CaO与水反应生成氢氧化钙是放热反应,向20℃时Ca(OH)2的饱和溶液甲中加入一定量的CaO溶液的温度升高,氢氧化钙的溶解度减小,氢氧化钙的溶解量减少,溶液中溶剂质量减少,氢氧化钙的溶解量减少,溶液中溶质的质量乙<甲;
(4)将pH试纸用蒸馏水润湿,再进行测定氢氧化钠溶液的pH值,会使得氢氧化钠溶液的碱性变弱,所以则所测得溶液的pH偏小;
(5)分别取少量溶液于两支试管中,然后分别通入二氧化碳气体,变浑浊的是澄清石灰水,无明显变化的是氢氧化钠溶液。
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年入冬以来,我们见识到了“空气杀手”——雾霾,直观的感受到雾霾天气给我们的生活带来的困扰。
对于一线城市来说,汽车尾气排放是雾霾天气形成的重要因素之一。科学分析表明,汽车尾气中含有多种污染物,如固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物(NOx)、铅及硫氧化合物等。目前最有效的汽车尾气治理方法是在发动机排气系统中加装催化转化器,其基本原理是通过催化剂的作用和一系列的氧化还原反应,使CO、NOx、碳氢化合物转化为对人体无害的二氧化碳(CO2)、氮气(N2)和水蒸气(H2O),该催化剂能同时对汽车尾气中的CO、NOx、碳氢化合物三种有害物起催化净化作用,因此这种催化剂被称为三效催化剂(TWC)。
TWC通常是以贵金属铂、铑、钯为活性组分,通过浸渍的方法分散在大比表面积的γ-Al2O3活性涂层上,并将γ-Al2O3涂附在熔点达1350℃的堇青石载体上制成。依据文章内容和下图,回答下列问题:
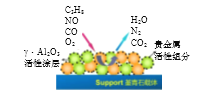
(1)三效催化剂主要由三部分组成,分别是_______________________。
(2)三效催化剂的成分之一堇青石的物理性质:____________________________。
(3)在三效催化剂发挥作用的一系列氧化还原反应中,有一步反应是:在催化剂的作用下,CO和NO反应生成CO2和N2,请写出该反应的化学方程式______________
(4)三效催化剂以γ-Al2O3活性涂层为活性组分的载体的原因是______________。
(5)科学家一直积极致力于开发新型的活性组分,如采用Mn、Fe、Cu等过渡金属为主要活性组分来取代贵金属,你认为该研发方向的优势是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是一款家用净水机内部结构图,根据图示回答下列问题
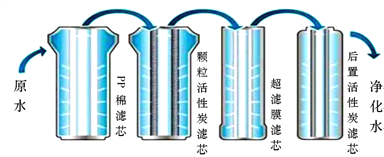
(1)原水经过pp棉膜滤芯后导出,这相当于我们学习过的__________操作。
(2)净水器用活性炭滤芯是因为活性炭具有_______________________________。
(3)该净水器导出的净化水煮沸后可以饮用,这里煮沸的作用主要是__________。
(4)实验室用通电分解水来测定水的组成,其化学方程式为____________________,得出的结论是________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组设计了一组“吹气球”实验,三套装置如图:
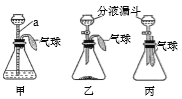
(1)甲装置:
①仪器a的名称为________________。
②向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性__________。
(2)乙装置:
①若生成O2使气球胀大,则锥形瓶中所装的固体物质可以是__________________。
②若生成二氧化碳使气球胀大,则反应的化学方程式为_______________________。
(3)丙装置:
若锥形瓶中装有硝酸铵固体,分液漏斗中加入少量水,则气球胀大的主要原因是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空:
(1)2个氮原子______;(2)3个碳酸根离子_______;
(3)氧化铁______;(4)保持水的化学性质的最小微粒:______;
(5)氧化铝中铝元素显+3价_______
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图实验装置,回答问题。
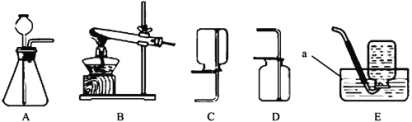
(1)图中仪器a的名称是___________。
(2)实验室用过氧化氢溶液和二氧化锰混合物制取氧气的化学方程式为______。用排空气法收集一瓶氧气,验满的方法是_____。用E装置收集氧气时,待集气瓶里的水排完后,_________,再小心地把集气瓶移出水槽,正放在桌面上.
(3)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。实验室中可以用浓氨水与生石灰制取氨气。请从如图中选出合适的仪器连接成一套制备并收集氨气的装置___________。
(4)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,固体药品只需盖满试管底部,液体药品取用____ mL。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(7分)将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g。求:(1)生成氧气多少克? (2)原氯酸钾的质量是多少克?
相关试题

