【题目】某兴趣小组为验证质量守恒定律,做了镁在空气中燃烧的实验。
(1)镁与氧气反应的化学方程式为_______________。
(2)根据质量守恒定律小明可知,反应后生成物的总质量应 (填“>”或“=”或“<”)参加反应镁的质量,但实际测量与之不符,小明认为这个反应不遵守质量守恒定律。
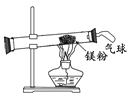
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体,氮化镁为黄色固体;
②氧化镁不溶于水,氮化镁能与水剧烈反应产生氨气,氨气能使湿润的红色石蕊试纸变蓝。
【猜想与假设】黄色固体是氮化镁
【进行实验】
实验操作及现象 | 实验结论 |
猜想正确 |
【实验反思】空气中N2的含量远大于O2的含量,而镁在空气中燃烧生成的氧化镁却远多于氮化镁,请给出合理的解释_____________。
(4)小丽继续进行镁与水反应的探究,做了如下实验:
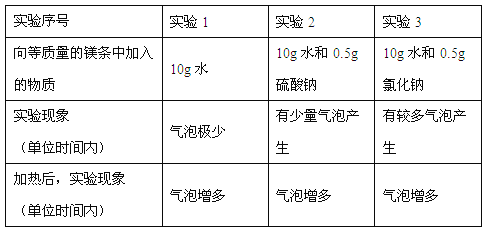
进行实验1的目的是_________________,根据上表中的实验现象,你能得出的结论是______________(写一条即可)。
参考答案:
【答案】(1)2Mg+O2![]() 2MgO(2)>
2MgO(2)>
(3)【进行实验】取少量黄色固体于试管中,加入适量的水,试管中有气体产生,再将湿润的红色石蕊试纸放在试管口,试纸变蓝。
【实验反思】O2比N2化学性质活泼
(4)做对比实验 氯化钠、硫酸钠可以加快反应速率或温度改变反应速率
【解析】
试题分析:(1)镁燃烧生成的是氧化镁:2Mg+O2![]() 2MgO;
2MgO;
(2)根据质量守恒定律化学反应前后物质的总质量不变,即参加反应的镁和氧气的质量总和等于生成的氧化镁的质量,故生成物的质量大于镁的质量;
(3)根据质量“氮化镁能与水剧烈反应产生氨气,氨气能使湿润的红色石蕊试纸变蓝”,故取少量黄色固体于试管中,加入适量的水,试管中有气体产生,再将湿润的红色石蕊试纸放在试管口,试纸变蓝,说明黄色固体是氮化镁,猜想正确;由于氧气的化学性质比氮气活泼,故镁先与氧气反应;
(4)实验1中不加任何物质,起对比的作用;由表格信息可知加入氯化钠、硫酸钠可以加快反应速率,且温度越高,反应速率越快。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是学习化学的重要工具,请用合适的化学用语回答:
(1)3 个氮气分子 ,2 个铝离子 。
(2)硫酸铵的化学式为 ,其中氮元素的化合价为 。
(3)天然气主要成分为甲烷,写出其在空气中充分燃烧的化学方程式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】牛奶中富含的维生素D有助于人体对钙的吸收,这里说的钙是指
A. 分子 B. 原子 C. 元素 D. 单质
-
科目: 来源: 题型:
查看答案和解析>>【题目】水是一种重要的资源。
(1)下列有关水的说法正确的是__________。
A.用肥皂水不能区分硬水和软水
B.生活中常用的硬水软化的方法是煮沸
C.水体有一定的自净能力,故工业污水可直接排放
D.河水经沉降、过滤、吸附操作后,可供人们日常饮用
(2)电影《火星救援》中马特·达蒙用液态的火箭燃料联氨(N2H4)在密闭容器中高温分解生成氮气、氢气和氨气(NH3),然后利用分解出的氢气燃烧制取水,解决了火星上缺少液态水的问题。请写出有关反应的化学方程式____________________,___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】达菲是目前治疗流感的最常用药物之一,也是公认的抗禽流感、甲型H1N1病毒最有效的药物之一。已知达菲的化学式为C16H31N2PO8
(1)达菲由 种元素组成;
(2)其中碳、氧元素的质量比为 。
(3)410克达菲中含有氧元素 克
-
科目: 来源: 题型:
查看答案和解析>>【题目】某纯净物4.6克,在氧气中完全燃烧生成8.8克二氧化碳和5.4克水,则下列正确的是:( )
A、该物质只含C、H两种元素
B、该物质一定含C、H两种元素,可能含有氧元素
C、该物质含C、H、O、三种元素
D、无法判断
-
科目: 来源: 题型:
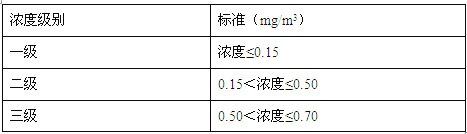
查看答案和解析>>【题目】我国空气质量标准对空气中二氧化硫的浓度级别规定如下表所示(空气中二氧化硫的浓度用单位体积的空气中所含二氧化硫的质量表示)。
某化学兴趣
小组为测定当地空气中二氧化硫的含量,将2 m3空气通入含碘(I2)量为2.54 mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是:SO2 + I2 + 2H2O ==H2SO4 + 2HI 。
通过计算说明此空气中二氧化硫的浓度级别。
相关试题

