【题目】某兴趣小组的同学们以“稀硫酸与氢氧化钠溶液能否发生反应”为课题进行了科学探究。
同学们在烧杯中加入10mL稀硫酸。滴入几滴酚酞试液,接着分两次向烧杯中滴入氢氧化钠溶液。第一次滴加几滴氢氧化钠溶液后,不断搅拌,第二次继续滴加氢氧化钠溶液至过量。则第一次滴加氢氧化钠溶液时,溶液中溶质(不考虑酚酞)的质量变化情况是__________:第二次滴加氢氧化钠溶液时观察到的现象是_______________________。
由上述实验同学们得出了稀硫酸与氢氧化钠溶液能发生反应的结论。
[提出问题]是否可以用其他试剂证明稀硫酸与氢氧化钠溶液能发生反应呢?
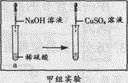
[甲组实验]实验过程如图所示:
现象:向a试管中滴加氢氧化钠溶液时无明显现象,再滴加几滴硫酸铜溶液时出现蓝色沉淀。
结论:用硫酸铜溶液可以证明稀硫酸与氢氧化钠溶液能发生反应。
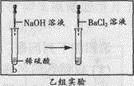
[乙组实验]实验过程如图所示:
现象:向b试管中滴加氢氧化钠溶液时无明显现象,再滴加几滴氯化钡溶液时出现白色沉淀。
结论:用氯化钡溶液可以证明稀硫酸与氢氧化钠溶液能发生反应。
[交流评价]请你评价甲、乙两组同学由实验现象获得的结论是否正确,并说明理由。
正确或错误 | 理 由 | |
甲组 | ||
乙组 |
参考答案:
【答案】硫酸减少,硫酸钠增多 溶液由无色变成红色
正确或错误 | 理 由 | |
甲组 | 正确 | a试管中出现蓝色的Cu(OH) 2沉淀,可知溶液中无稀硫酸,说明H2SO4与NaOH反应已被耗尽,所以甲正确。 |
乙组 | 错误 | H2SO4和Na2SO4与BaCl2反应均能产生白色沉淀,不能说明H2SO4与NaOH反应,所以乙组不正确。 |
【解析】氢氧化钠与稀硫酸反应生成硫酸钠和水,故第一次滴加氢氧化钠溶液时,随着反应的进行,硫酸的量逐渐的减少,硫酸钠的量逐渐的增多;氢氧化钠溶液呈碱性,能使无色的酚酞试液变成红色,故第二次继续滴加氢氧化钠溶液至过量,溶液由无色变成红色。甲组用硫酸铜检验,硫酸与蓝色沉淀氢氧化铜反应生成硫酸铜和水,只要有硫酸就不会产生蓝色沉淀,所以用硫酸铜可以检验硫酸和氢氧化钠是否反应;乙组中硫酸和硫酸钠都能和氯化钡反应产生硫酸钡白色沉淀,不能说明硫酸与氢氧化钠反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
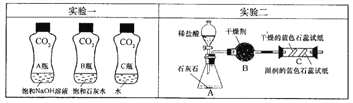
【活动与探究一】用对比实验方法探究二氧化碳的性质。
(1) 实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A > B > C,其中变浑浊的瓶内发生反应的化学方程式为____________________________;对比A瓶与______(填“B”或“C”)瓶的实验现象,可证明C02能与NaOH发生反应。
(2) 实验二观察到C装置中发生的现象是______________________结论是__________________________(用化学方程式表示)。
【活动与探究二】用变量控制方法探究影响物质溶解性的因素。
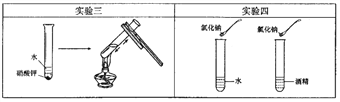
(3)实验三目的是探究________对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和__________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】取用液体药品时,标签要朝向______,目的是________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
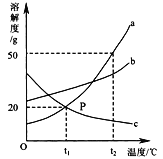
(1)如果t1℃代表20℃时,那么 a物质的溶解性为____________
(2)欲将t2℃时C物质的饱和溶液变为不饱和溶液,可采用的方法是 _______、___________ ;
(3) t2℃时将30g a物质加入到50g水中充分溶解,所得溶液的溶质质量分数是______。
(4)t2℃时,将a、b两物质的饱和溶液各100g,分别降温到t1℃,所得a物质溶液的质量 ______b物质溶液的质量(选填“>”或“=”或 “<”)
(5)t1℃时,a物质进行以下实验:
10ml水
 溶液X
溶液X 溶液Y
溶液Y  溶液Z
溶液Z则所得溶液x、y、z中,为饱和溶液的是______________ 。
(6)除去a固体中混有的少量固体b,提纯的步骤是:加水溶解、________ 、_______ ,然后过滤、洗涤、干燥。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
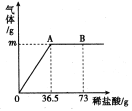
⑴A点产生气体的质量为 ;
⑵试样中碳酸钠的质量分数(结果精确到0.1%);
⑶B点时,烧杯内溶液中溶质的化学式 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是KCl与KNO3的溶解度曲线。则下列说法正确的是( )
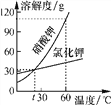
A. 硝酸钾的溶解度比氯化钾大
B. 30 ℃两溶液的溶质质量分数可能相等
C. 在t ℃时,硝酸钾和氯化钾溶液的质量一定相等
D. 在60 ℃时,两物质各100 g分别加入100 g水中,充分溶解,均有固体剩余
-
科目: 来源: 题型:
查看答案和解析>>【题目】回答下列问题:
(1)在实验室里取用固体药品可用药匙或镊子。取用碳酸钠粉末选_____,取用块状大理石选用_____。
(2)在实验室里,取用少量液体时常用_______,向试管中加入较多的液体时用_______的方法。
相关试题

