【题目】某粗盐样品中含有杂质氯化镁、氯化钙.某同学设计了以下提纯方案:

请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的 。
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是 。
(3)滤液B中所含的溶质为 。
(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为 时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分 (填“有”或“没有”)影响。
(5)操作C的名称为 。
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式 。
参考答案:
【答案】(1)氯化镁;(2)漏斗;(3)氯化钠、氢氧化钠,碳酸钠;(4)无气泡放出;没有;(5)蒸发;(6)2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
【解析】试题分析:(1)因为钠盐都溶于水,而氢氧根离子会将镁离子转化为氢氧化镁沉淀,生成氯化钠;(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒;(3)前面的除杂各步后都生成氯化钠,但是在除杂时加入的氢氧化钠和碳酸钠(除去氯化钙时,用过量的碳酸钠,即过量的试剂b)都是过量的;(4)向滤液B滴加稀盐酸的过程中,当观察到溶液中不产生气泡时,说明恰好完全反应,停止滴加;过量的稀盐酸对最后得到的精盐晶体的成分没有影响,因为稀盐酸不与氯化钠反应;(5)得到精盐晶体之前的操作是蒸发;(6)由分析可知,反应物、生成物、反应条件;故可书写此化学方程式为:2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
-
科目: 来源: 题型:
查看答案和解析>>【题目】粗盐提纯实验中,经分析发现测得的纯度偏低,不可能的原因是
A.食盐没有全部溶解即过滤
B.蒸发过程中晶体飞溅
C.蒸发后所得精盐很潮湿
D.蒸发皿上沾有精盐没有全部转移到称量纸上
-
科目: 来源: 题型:
查看答案和解析>>【题目】用氯化钠固体配制一定质量分数的氯化钠溶液,必须使用的一组仪器是
A.天平、烧杯、量筒、玻璃棒、药匙
B.天平、烧杯、漏斗、蒸发皿、玻璃棒
C.天平、烧杯、量筒、铁架台、药匙
D.天平、集气瓶、漏斗、蒸发皿、玻璃棒
-
科目: 来源: 题型:
查看答案和解析>>【题目】右图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。
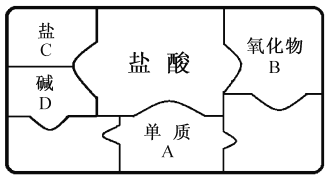
(1)A不可能是______(填标号)。
a.Mg b.Fe c.Ag d.Zn
(2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为______。
(3)若C为碳酸钠
①C与D的反应属于______(填基本反应类型)。
②D与盐酸反应的化学方程式为______(写一个)。
③将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有______种。
-
科目: 来源: 题型:
查看答案和解析>>【题目】属于混合物的是
A.蒸馏水 B.氧气 C.石灰水 D.氯酸钾
-
科目: 来源: 题型:
查看答案和解析>>【题目】微观解释不正确的是
A.酒精挥发﹣﹣分子不断运动
B.二氧化碳气体制成干冰﹣﹣分子体积变小
C.18g水中大约有6.02×1023个水分子﹣﹣分子质量很小
D.50mL酒精和50mL水混合后总体积小于100mL﹣﹣分子间有间隔
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如图所示,据图回答下列问题:
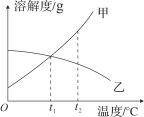
(1)乙物质的溶解度随温度的升高而 (填“增大”或“减小”)。
(2)欲将t1℃甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法: (任填一种)。
(3)若甲物质中混有少量乙物质,可用 的方法提纯甲。
(4)等质量甲、乙两种物质分别配成t2℃时的饱和溶液, 需要水的质量大小关系是甲 乙(填“>”、“=”或“<”)。
相关试题

