【题目】某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4丶KCl和KOH中的种或几种。为探究其组成,流程和现象记录如下:
【资料】CaCl2、BaCl2、KCl三种溶液均呈中性
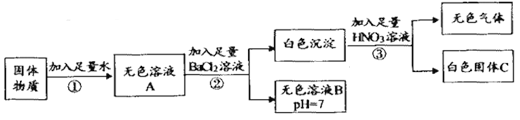
(1)依据步骤①的实验现象得出该固体物质中一定______(选填“有”或“没有")CuSO4,由无色溶液B的pH=7,可得出该固体物质中一定不含______ (填化学式,下同)。
(2)步骤②中发生的化学方程式为______ (写出一个即可)。
(3)依据步骤②③的现象可得出因体物质中一定含有______,由此还可以推断出该固体物质中CaC2是______ (选填“一定有”、“一定没有"、“可能有”)。
(4)取图中无色溶液B,依次滴加AgNO3和稀HNO3,______(选填“能”或“不能”)检验原固体中是否含有KC1,理由是___。
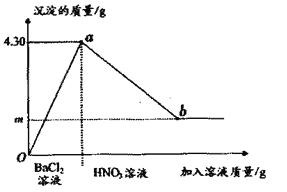
(5)在整个实验过程中加入溶液的质量与产生沉淀质量关系如图所示。则b点时沉淀的化学式为______在步骤③过程中,生成气体的质量为0.44g,则m点的数值是______。
参考答案:
【答案】 没有 KOH Na2SO4 + BaCl2 = BaSO4 ↓ +2NaCl ( Na2CO3 + BaCl2 = BaCO3 ↓ +2NaCl 均可) Na2SO4、Na2CO3 (漏答或错答不给分) 一定没有 不能 步骤②中加入BaCl2引入Cl- BaSO4 2.33
【解析】根据所学知识和题中信息知,①加水得无色溶液,故没有硫酸铜,碳酸钠或氯化钙。②进入足量氯化钡溶液,有白色沉淀产生,一定有碳酸钠或硫酸钠,溶液呈中性,一定没有氢氧化钾。③加入足量硝酸,有无色气体和白色沉淀生成,一定有碳酸钠和硫酸钠。(1)依据步骤①的实验现象得出该固体物质中一定没有CuSO4,由无色溶液B的pH=7,可得出该固体物质中一定不含KOH。(2)步骤②中发生的化学方程式为Na2SO4 + BaCl2 = BaSO4 ↓ +2NaCl。(3)依据步骤②③的现象可得出因体物质中一定含有Na2SO4、Na2CO3。,由此还可以推断出该固体物质中CaCl2是一定没有. (4)取图中无色溶液B,依次滴加AgNO3和稀HNO3, 不能检验原固体中是否含有KC1,理由是步骤②中加入BaCl2引入Cl-.(5)在整个实验过程中加入溶液的质量与产生沉淀质量关系如图所示。则b点时沉淀的化学式为BaSO4,在步骤③过程中,生成气体的质量为0.44g,则m点的数值是∶BaCO3→CO2 , ![]() =
=![]() ,x=2.33g.
,x=2.33g.
点睛∶本题主要考查物质成分的推断。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b、c三种物质的溶解度曲线,下列说法中正确的是

A. t1℃时,a物质的饱和溶液中溶质和溶剂的质量比为1:4
B. 任何温度时,a、c两种物质的饱和溶液的质量分数都是a>c
C. t1℃时b物质的饱和溶液,升温至t2℃时仍是饱和溶液
D. 将等质量三种物质的溶液从t2℃降至t1℃,析出晶体最多的是a物质
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定的条件下,在一个密闭容器中发生某反应,测得反应前后各物质的质量如下图所示、下列判断不正确的是

A. 表中a的值为2.8 B. 实验中的CO2和X的分子个数为1:1
C. X中一定不含氢元素 D. 若起始时氧气质量是14.4g,则无X生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化中,属于化学变化的是( )
A. 铁锅生锈 B. 电灯发光发热 C. 分离液态空气 D. 冰川融化成水
-
科目: 来源: 题型:
查看答案和解析>>【题目】请你根据如图所示回答有关问题:

(1)图一中仪器A的名称是______,仪器C的名称是___。
(2)实验室制二氧化碳的化学反应方程式为______,利用图一中仪器组装制二氧化碳的发生装置,可选用的仪器有______ (填序号),利用该发生装置还可以制的另一种气体是______。 图二是两套干燥气体装置,可用于干燥二氧化碳的是______ (选填“甲”或“乙”),气体从该装置的______ (选填“左”或“右”)端通入,不能选择另一套的原因是_____ (用化学方程式表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们做完实验后的玻璃试管中常附着难清洗的物质,下列清洗方法错误的是
A.内壁有CaCO3的试管用稀盐酸清洗
B.内壁有碘的试管用酒精清洗
C.内壁有铜粉的试管用稀硫酸清洗
D.内壁有植物油的试管用洗洁精清洗
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用你所学的化学知识,完成下列相关问题
(1)化石燃料包括煤、______和天然气,是______ (填“可”或“不可”)再生能源。煤是复杂的混合物,主要含有______元素,不完全燃烧产生的______会造成“煤气中毒”。
(2)Ga材料的研究与应用是目前全球半导体研究的前沿和热点。制备氮化镓(GaN)化学原理是:GaCl3+NH3
 GaN+3X,其中X的化学式为___。
GaN+3X,其中X的化学式为___。(3)粗盐主要成分的化学式为______。某同学取50g粗盐提纯并计算产率:①将粗盐逐渐加入10mL水中,直到不再溶解,剩余粗盐10g;②取①中浊液______ (填操作名称);③蒸发滤液;④得到精盐3.2g,则精盐产率为______,在步骤①②③中都要用到的一种玻璃仪器是___。
(4)现将2000g含氯化钠3%的海水暴晒后,蒸发掉500g水(无晶体析出),此时剩余海水中氯化钠的质量分数为___。
相关试题

