【题目】金属材料与人类的生产、生活息息相关。学习常见金属的性质和金属的活动性顺序,能帮助我们发现和研究更多的金属。
(1)人们习惯上称为“五金”的金、银、铜、铁、锡中,把金属______(填元素符号)的位置移到最后,正好符合金属活动性由_____(填“强到弱”或“弱到强”)的顺序。
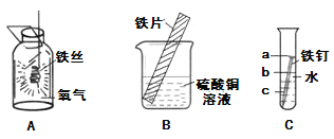
(2)根据上图回答有关问题:
①写出实验A中存在的一处明显错误__________。
②实验B中可观察到铁片的表面_________现象。
③实验C中可观察到试管中铁钉最先生锈的是______处。(填“a”或“b”或“c”)
(3)所谓合金,就是不同种金属(或金属与非金属)在熔化状态下形成的一种熔合物。
Na | Cu | Al | Fe | |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
根据上表中四种金属的熔沸点,判断其中不能形成合金的是_______。
a.Cu和Al b.Fe和Cu c.Fe和Na
参考答案:
【答案】Fe 弱到强 集气瓶底部未放少量的水或铺一薄层细沙 覆盖一层红色物质 b c
【解析】
(1)常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,把铁放到最后,正好金属活动性由弱到强,所以依据金属活动性顺序可知,金、银、铜、锡、铁活动性由弱到强;
(2)①图示为铁丝在氧气中燃烧,实验A中存在的一处明显错误是:集气瓶底部未放少量的水或铺一薄层细沙;
②铁片放入蓝色硫酸铜溶液,铜被置换出来,所以会看到铁片的表面覆盖一层红色物质的现象;
③铁在与氧气、水同时接触时生锈,图中所示实验b处既接触水又接触氧气,所以最先被锈蚀,所以最先生锈的是b处;
(3)合金是不同种金属在熔化状态下形成的一种熔合物,即两种金属都成为液态时进行混合;由于金属钠的沸点较低,在铁熔化时温度达1535℃,而此时金属钠已变成气态,无法完成液态时混合。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,按要求回答有关问题:

(1)写出图中带有标号仪器的名称:a ___________;b ___________。
(2)实验室用加热高锰酸钾制取氧气时,应选择的发生装置是_____(填写装置的字母代号,下同),该装置有一处不足是__________,所发生反应的化学反应方程式为_________;基本反应类型为___________。
(3)实验室制取二氧化碳气体时,应选择的发生装置为______,应选用的收集装置是_____。检验二氧化碳是否收集满的方法是:将燃着的木条放在_________,观察火焰是否熄灭。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在牙膏和一些补钙的药品中,常用轻质碳酸钙粉末作填充剂或载体。碳酸钙也是石灰石和大理石的主要成分,请你计算:
(1)碳酸钙的相对分子质量____________;
(2)碳酸钙中钙、碳、氧三种元素的质量比__________;(最简整数比)
(3) ___________克的碳酸钙中含有3克碳元素;
(4)碳酸钙中钙元素的质量分数____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求用正确的化学符号回答。
(1)2个氮原子_________ ; (2)3个硫酸根离子_________ ;
(3)硝酸银 _________ ; (4)氧化铝中铝元素显+3价_________ ,
(5)吸烟的烟雾中有一种有毒气体_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~F是初中化学常见物质,相互转化关系如图(部分反应物或生成物及反应条件略)。
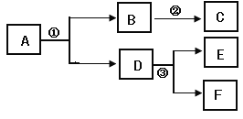
(1)若常温下,A为无色有气味的液体,是可再生能源的主要成分,相对分子质量为46,则A的化学式_________ 。
(2)若A常温下为无色液体,加入二氧化锰时能发生分解反应,该反应的化学方程式为_____;
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答问题。
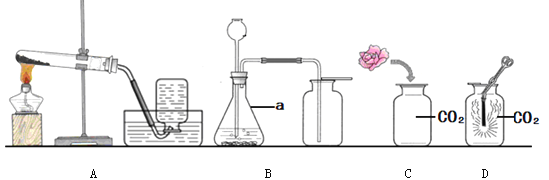
(1)仪器a的名称是_______;
(2)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为__________ ,应选用的装置是_______(填序号),收集一瓶二氧化碳时,将燃着的木条放在瓶口,若观察到_________,说明瓶中已充满二氧化碳;
(3)取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置C中,可观察到的实验现象是_____,此现象说明CO2具有的化学性质是______________________;(用化学方程式表示)
(4)小明在查阅资料时发现镁条能在CO2中燃烧,他在装置D中进行实验,发现镁条剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体。这个实验使你对物质燃烧的条件产生的新认识是__________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验创新小组对木炭还原氧化铜的实验进行了改进,其操作步骤如下:
(1)取一片铜片,用砂纸除去其表面的氧化物使其表面呈光亮的红色;
(2)用洒精灯将上述铜片烧到红热后,立即伸入到集满氧气的集气瓶中,观察到的现象为:铜片表面变成_____ 色,用到的夹持仪器是_____(填名称);
(3)在一支干燥的大试管中装入一定量的经烘干处理过的木炭粉,再将经过(2)处理过的铜片部分埋入木炭粉中;
(4)按照如图所示的装置图连接好各种仪器;
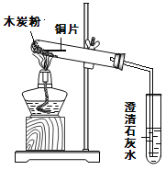
(5)加热大试管,其中发生的反应的化学方程式为:_________________________,当观察到澄清石灰水变浑浊后,先移走导管,后停止加热;若“先”、“后”颠倒,造成的后果是___________;石灰水变浑浊的原因是(用化学方程式表示)_____________________.
(6)待试管冷却后,取出铜片,洗净后观察;铜片表面埋入木炭粉的部分_______.
相关试题

