【题目】在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
反应前质量/g | 100 | 1 | 1 | 46 |
反应后质量/g | 4 | 89 | 55 | x |
(1)根据质量守恒定律,你认为x的值应为_____________。
(2)未知物质M一定含有的元素为______________________。
(3)已知未知物质M的相对分子质量为46,推出其化学式为_____________。
(4)该反应的化学方程式为______________________________。
参考答案:
【答案】0 C、H、O C2H5OH C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
【解析】
根据质量守恒定律,由表中数据可知:二氧化碳的质量增加了89g-1g=88,可确定二氧化碳是生成物;水蒸气的质量增加了55g-1g=54g,可确定水蒸气是生成物;氧气的质量减少了100g-4g=96g,可以确定氧气是反应物;同时可以确定M是反应物;(1)M减少的质量为88g+54g-96g=46g,因此x的值为46-46=0;
(2)因反应物中的氧气里只含氧元素,因此生成物中的碳元素和氢元素一定来自M,即M中一定含有碳、氢两种元素;生成物中氧元素的质量为88g×![]() ×100%+54g×
×100%+54g×![]() ×100%=112g>96g,确定生成物中的一部分氧元素来自M,即M中一定含有氧元素;
×100%=112g>96g,确定生成物中的一部分氧元素来自M,即M中一定含有氧元素;
(3)M中碳、氢、氧三种元素的原子个数比为:(88g×![]() ÷12):(54g×
÷12):(54g×![]() ÷1):(16g÷16)=2:6:1,又因为M的相对分子质量为46,所以M的化学式是C2H5OH;
÷1):(16g÷16)=2:6:1,又因为M的相对分子质量为46,所以M的化学式是C2H5OH;
(4)该反应的化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O。
2CO2+3H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下 表,则下列表述正确的是( )
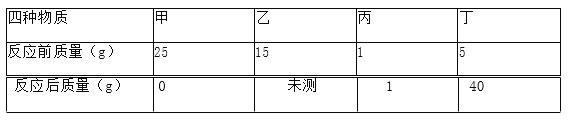
A. 未测值为 10g B. 丙一定是催化剂
C. 乙全部发生了反应 D. 甲与乙反应的质量比为 5:2
-
科目: 来源: 题型:
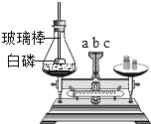
查看答案和解析>>【题目】如图是测定白磷燃烧前后质量的变化情况,用来检验质量守恒的实验,试 回答:
(1)此反应是否符合质量守恒定律?_____(填“符合”或“不符合”).如果符合请从原子的角度,简要分析你认为符合的理由:_________.
(2)白磷燃烧时,观察到的现象是_____.
(3)做这个实验前锥形瓶应预先装少量的细砂的原因是_____.
(4)将橡皮塞上的玻璃棒放在酒精灯上灼烧到红热后,迅速用橡皮塞将锥形瓶 塞紧,并将白磷引燃,这里要“迅速用橡皮塞将锥形瓶塞紧”的原因是_____.
(5)若上述的橡皮塞没有塞紧,结果天平的指针会在_____处(填“a”或“b”或 “c”).
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们以“化学反应中,反应物与生成物的质量关系”为课题进行探究.经讨 论分析、查阅资料后设计了 A、B 两套实验装置,并在实验过程中做到操作规范、 准确称量和细致观察.实验完毕后,使用 A 装置进行实验得到的结果是:在发生 化学反应前后,反应物的总质量与生成物的总质量相等;而使用 B 装置进行实验 得到的结果是:在发生化学反应前后,反应物的总质量与生成物的总质量不相等. 请你
两个实验都符合质量守恒定律吗?_________(填“符合”或“不符合”). 导致出现两种不同结果的原因是_____.

-
科目: 来源: 题型:
查看答案和解析>>【题目】下面关于水电解实验的叙述正确的是( )
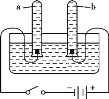
A. 实验说明水是由氢、氧两种元素组成的
B. 实验说明水是由氢气和氧气组成的
C. b试管产生的气体能在空气中燃烧
D. 若a试管中收集到的气体为5 mL,则b试管中收集到的气体为10 mL
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示物质的分类和转化关系,请据图填写下列空白:

物质类别:①___,②___; 变化类型:③___;
物质名称:④___,⑤___(注:④、⑤两空所填的物质之间不必存在联系)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请回答下列问题:
(1)电解水可以得到氢气和氧气,说明水是由氢、氧两种______(填“分子”“原子”“元素”或“离子”)组成的化合物。
(2)下列物质属于纯净物的是______(填字母序号)。
A.自来水 B.冰水混合物 C.河水 D.蓝墨水
(3)生活中,人们常采用______的方法,既降低水的硬度,又杀菌消毒。
(4)如图是“国家节水标志”,请你列举一种生活中具体的节水措施______。

相关试题

