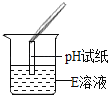
【题目】化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液)。其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:
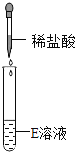
【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液不可能是_______(填序号)①酸;②碱;③盐。
【提出猜想】
猜想Ⅰ:NaOH溶液;
猜想Ⅱ:Na2CO3溶液;
猜想Ⅲ:Na2SO4溶液;猜想Ⅳ:____溶液(任写一种).
设计并实验兴趣小组的同学为验证“猜想Ⅱ”是否正确,设计并完成如下表所示实验。
实验方案 | 实验一 | 实验二 | 实验三 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | _____________ |
实验结论 | 猜想Ⅱ正确 | ||
【分析与推理】
①完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是_________________________。
②请写出“实验三”中发生反应的化学方程式___________________________。
【反思与评价】
经过讨论,同学们认为实验中存在明显操作错误,该错误是___________________。
参考答案:
【答案】 ① NaCl 或NaNO3或NaHCO3(合理即可) 白色沉淀 碳酸钠溶液也显碱性 Na2CO3+BaCl2=2NaCl+BaCO3↓ pH试纸浸入待测液
【解析】【初步判断】根据实验室药品分类摆放的原则分析可知该药品是按照酸碱盐顺序摆放的,由于该试剂瓶左侧是碱类物质右侧是盐类物质,所以该物质的类别应该是碱或者盐类物质,因此可猜断该物质不可能为酸;【提出猜想】由于该试剂中含有钠元素,则若为碱,则为氢氧化钠;若为盐,则可为碳酸钠或是硫酸钠或氯化钠等;【设计并实验】碳酸钠和氯化钡反应产生碳酸钡白色沉淀和氯化钠,因此会产生的现象为:有白色沉淀产生;【分析与推理】①由于氢氧化钠和碳酸钠溶液都显碱性,因此测得的pH>7,故无法判断是哪一种物质;②碳酸钠和氯化钡反应产生碳酸钡沉淀和氯化钠,反应的方程式为:Na2CO3+BaCl2=2NaCl+BaCO3↓;【反思与评价】使用pH试纸测定溶液酸碱度时应该用玻璃棒蘸取待测液滴在试纸上,而不应该浸入待测液,否则会造成试剂的污染。
-
科目: 来源: 题型:
查看答案和解析>>【题目】卟啉类化合物在医药、催化等领域有着很好的应用前景,以四氨基苯基卟啉为例(分子式C44H34N8),下列关于四氨基苯基卟啉说法正确的是( )
A. 四氨基苯基卟啉由三个元素组成
B. 四氨基苯基卟啉由86个原子构成
C. 一个四氨基苯基卟啉分子的相对分子质量为674g
D. 四氨基苯基卟啉中碳元素的质量分数78.3%
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是
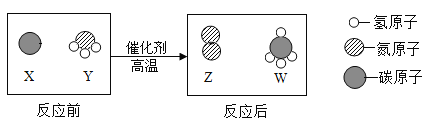
A.化学反应前后原子的种类、个数、质量均保持不变
B.W物质中碳元素的质量分数为75%
C.参加反应的X、Y两物质的粒子个数比为3:4
D.该反应不属于置换反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题:
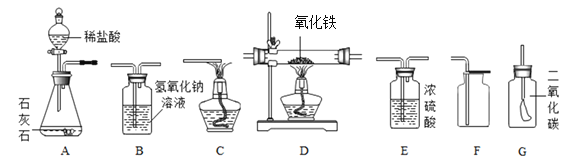
(1)欲在实验室中制备并收集干燥的二氧化碳气体。
①所选仪器的连接顺序为_________________(填写仪器序号字母)。
②仪器A中,发生反应的化学方程式为_____________________。
③若向G装置中倒入适量澄清石灰水,迅速用预先绑有小气球的橡皮塞塞紧,振荡,观察到的气球出现的现象是_______________________。
(2)欲用混有少量二氧化碳的一氧化碳气体还原氧化铁,所选仪器的连接顺序为:混合气体→D→B→C。进行实验时,D装置玻璃管中的现象是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
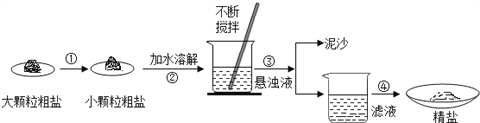
(1)操作③的名称是_________________
(2)操作④中用到玻璃棒,作用为_____________________。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是__________(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上。
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
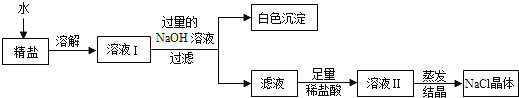
①白色沉淀的化学式为_______。
②在得到的滤液中加入足量的稀盐酸的目的是____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应属于置换反应的是( )
A. 丙烷燃烧:C3H8+5O2
 3CO2+4H2O
3CO2+4H2OB. 铝的冶炼:2Al2O3
 4Al+3O2↑
4Al+3O2↑C. 湿法炼铜:Fe+CuSO4═Cu+FeSO4
D. Cl﹣的检验:AgNO3+NaCl═NaNO3+AgCl↓
-
科目: 来源: 题型:
查看答案和解析>>【题目】“让邵阳茶油飘香全国”茶油中所含柠檬醛(化学式为C10H16O)能抑制黄曲霉菌的活性,对
冠脉,心血管病有较好疗效。下列关于柠檬醛叙述正确的是
A. 柠檬醛是由10个碳原子、16氢原子和1个氧原子构成
B. 柠檬醛是由碳、氢、氧三种元素组成的,但它不属于氧化物
C. 柠檬醛中,碳、氢、氧元素的质量比为10:16:1
D. 柠檬醛中,氧元素的质量分数最小
相关试题