【题目】实验室中有一瓶含有少量氯化钠和可溶性杂质的硫酸钠样品.某化学兴趣小组对该样品成分进行定量测定,甲、乙、丙三位同学分别称取一定质量的样品放入烧杯中,溶入足量水后过滤得到滤液;再向滤液中加入一定质量的氯化钡溶液,充分反应后过滤,将沉淀洗涤、干燥并称量.相关实验数据记录如下:(Na2SO4+BaCl2=BaSO4↓+2NaCl)
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 15 | 15 | 20 |
加入氯化钡溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 23.3 | 23.3 | 23.3 |
请回答下列问题:
(1)__________同学(选填“甲”“乙”或“丙”)所取用的样品与氯化钡溶液恰好完全反应.
(2)计算该样品中硫酸钠的质量分数.(写出计算步骤,计算结果保留到0.1%)
(3)若欲计算出样品与氯化钡溶液恰好完全反应时所得溶液的溶质质量分数,上述实验过程中还需要测定的数据是__________.
参考答案:
【答案】(1)乙;(2)94.7%;(3)水的质量.
【解析】
试题分析:解:(1)甲、乙比较,100g氯化钡完全反应,乙、丙比较, 15g样品完全反应,所以乙同学所取用的样品与氯化钡溶液恰好完全反应;
(2)设参加反应的硫酸钠为x,
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
x 23.3g
![]() =
=![]()
x=14.2g
所以样品中硫酸钠的质量分数为:![]() ×100%=94.7%;
×100%=94.7%;
-
科目: 来源: 题型:
查看答案和解析>>【题目】秋冬之交,我国北方地区频现雾霾天气,雾霾中含有大量的PM2.5颗粒物导致呼吸病人增多,为了减少空气污染,下列措施正确的是:
A.露天焚烧垃圾 B.开发新能源如:太阳能
C.汽车排放尾气 D.多用煤作燃料
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中,不能用金属跟稀酸反应直接制得的是( )
A. 硫酸锌 B. 氯化镁 C. 氯化铁 D. 硫酸铝
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题。

(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解 g乙,溶液达到饱和;
(2)t2℃时,比较两物质的溶解度大小: ;
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (写出一种即可);
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化属于物理变化的是
A.酒精燃烧 B.铁生锈 C.工业制氧气 D.以粮食为原料酿酒
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了比较人体呼出的气体和吸入的空气中二氧化碳含量的高低,某化学小组为了对人体呼出的气体和吸入的空气中,二氧化碳含量的比较设计如下实验:
问题:人体呼出的气体和吸人的空气中,所含的成分相同吗?为了比较其中二氧化碳含量的高低,某化学活动小组的同学设计了下图所示的装置。
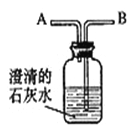
实验:
(1)首先,由导管口 吸气约 30 S,观察到澄清的石灰水 ,说明空气中二氧化碳的含量 。
(2)然后,从导管口 吹气约 30 S,观察到澄清的石灰水 ,说明呼出的气体中二氧化碳的含量 。
(3)综合上述实验结果可知,人体呼出的气体中所含的二氧化碳比空气中的更 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列对分子、原子与离子的认识正确的是
A.原子是最小的粒子,不可再分
B.离子不能直接构成物质
C.“花香四溢”是因为分子在不断运动
D.空气是由空气分子构成的
相关试题

