【题目】(2018十八县联考)在学习盐酸的化学性质时,甲、乙两位同学分别做了碳酸钠溶液和稀盐酸反应的实验(如图)。
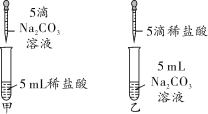
(实验现象)甲同学的实验溶液中有气泡冒出,乙同学的实验溶液中无气泡冒出。
写出甲同学实验中涉及反应的化学方程式:_______。
(实验讨论)乙同学实验的溶液中为什么没有现象?
(查阅资料)(1)碳酸钠和稀盐酸反应不仅可以生成二氧化碳,还可以生成碳酸氢钠;
(2)碳酸氢钠与氯化钙溶液混合不发生反应。
(实验设计)证明乙同学实验溶液中含有碳酸氢钠。
实验步骤 | 可能现象 | 实验结论 |
(1)取上述乙同学实验后的溶液少量于试管中,加入足量的____(写化学式)溶液 | 产生白 色沉淀 | |
(2)取步骤(1)所得上层清液少量,滴加_____ | _____ | 无色溶液 中含碳酸 氢钠 |
写出步骤(1)中涉及的化学反应方程式:_________。
(实验反思)(1)Na2CO3和稀盐酸反应的生成物种类受稀盐酸的量的影响,稀盐酸____(填“足量”或“不足”)时才能有气泡冒出。
(2)当反应物的量不同时,产物可能不同,试另举一例:______。
【答案】Na2CO3+2HCl=2NaCl+H2O+CO2↑ CaCl2 稀盐酸(合理即可) 有气泡冒出 CaCl2+Na2CO3 =CaCO3↓+2NaCl 足量 木炭燃烧时,若氧气不足时生成CO,若氧气充足时生成CO2(合理即可)
【解析】
【实验现象】碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应方程式为Na2CO3+2HCl === 2NaCl+H2O+CO2↑。【实验设计】(1)碳酸氢钠与氯化钙不反应,而碳酸钠与氯化钙反应能产生白色沉淀,所以加入足量CaCl2溶液,通过产生白色沉淀证明并除去碳酸钠,反应方程式为CaCl2+Na2CO3 === CaCO3↓+2NaCl,然后再向步骤(1)所得上层清液中加入稀盐酸,若有气泡冒出,则说明含有碳酸氢钠。【实验反思】(1)由实验操作可知,向稀盐酸中逐滴加碳酸钠溶液,有气泡冒出;向碳酸钠溶液中逐滴加稀盐酸,无气泡冒出,所以碳酸钠与稀盐酸反应,当稀盐酸为足量时才有气泡冒出。(2)碳在充足的氧气中燃烧生成二氧化碳、在不充足的氧气中燃烧生成一氧化碳,就是因为反应物量的不同,所以生成物不同。

