【题目】把干燥、纯净的氯酸钾和二氧化锰的混合物31.5g装入大试管中,加热制取氧气。待完全反应后,将试管冷却、称量,得到21.9g固体物质。计算制得氧气多少克?21.9g固体物质中含有哪些物质?各多少克?
参考答案:
【答案】9.6g;氯化钾14.9g、二氧化锰7g。
【解析】氯酸钾在二氧化锰的作用下分解生成氯化钾、氧气,据质量守恒定律可知反应前后物质的总质量不变,所以氧气的质量为31.5g-21.9g=9.6g;因完全反应,所以反应后的固体中有氯化钾和二氧化锰,设反应生成氯化钾的质量为x
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
149 96
x 9.6g
149/x=96/9.6 x=14.9g
二氧化锰的质量为21.9g-14.9g=7g
答:略
-
科目: 来源: 题型:
查看答案和解析>>【题目】图示中A——F是初中化学常见的物质。按单质、氧化物、酸、碱、盐分类,A、B、C、D、E是五种不同类别的物质,F是大理石的主要成分。图中“--”表示相连的两种物质之间可以发生反应,“→”表示物质间存在着相应的转化关系(部分反应物、生成物及反应条件已略去)。请回答:

(1)物质F的化学式:________;
(2)反应② 的化学方程式________;
(3)反应① 的基本反应类型是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列应用在高铁列车上的材料,不属于金属材料的是( )
A.铜线 B.铝合金 C.不锈钢 D.玻璃钢
-
科目: 来源: 题型:
查看答案和解析>>【题目】水与人类的生活息息相关。
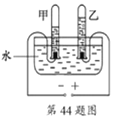
(1)保持水的化学性质的最小粒子是_____(用化学符号表示)。
(2)上图是“电解水实验”示意图,图中试管乙中的气体是______。
(3)生活中,人们常用肥皂水检验水样品是硬水还是软水。肥皂水遇______(填“硬水”或“软水”)泡沫少、易起浮渣。
-
科目: 来源: 题型:
查看答案和解析>>【题目】碳酸锌与碳酸钙其有相似的化学性质。现将12.5g碳酸锌固体高温锻烧一段时间,冷却后,向剩余固体中加入足量稀硫酸。下列结论正确的个数是
①共生成16.1g硫酸锌
②煅烧越充分则消耗的硫酸越少
③煅烧后固体中氧元素的质量分数减小
④最终生成二氧化碳的总质量与煅烧时间的长短有关
A.1个 B.2个 C.3个 D.4个
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质(均不含结晶水)的溶解度曲线如右图所示。下列说法正 确的是
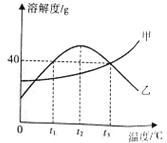
A.t1℃时,甲的溶解度大于乙的溶解度
B.t2℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3℃降温到t1℃,乙溶液中的溶质质量分数会发生改变
D.t3℃时,50g水中加入40g的甲物质充分溶解可得到90g甲的饱和溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】在由CH4和H2组成的混合气体中,测知碳元素的质量分数为60%,则混合气体充分燃烧生成二氧化碳和水的质量比为( )
A.11∶18 B.22∶9 C.1∶1 D.11∶27
相关试题

