【题目】下列装置常用于实验室制取气体。请根据给出的装置回答下列问题:

(1)写出仪器①的名称_____。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是___(填序号),化学方程式是____。
(3)用B和E装置制取并收集CO2,反应的化学方程式为____。选择装置B作为制取CO2气体的发生装置,其突出优点是____,若改用F装置收集二氧化碳,则气体应从_____(填“a”或“b”)端进入。制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→____→____→___→____(用导气管端口字母表示)。
参考答案:
【答案】长颈漏斗 A 2KClO3 ![]() 2KCl+3O2 ↑ CaCO3+2HCl=CaCl2+CO2+H2O 可以控制反应的发生和停止 b e f c d
2KCl+3O2 ↑ CaCO3+2HCl=CaCl2+CO2+H2O 可以控制反应的发生和停止 b e f c d
【解析】
(1)仪器①的名称为:长颈漏斗;
(2)用氯酸钾制氧气,反应物是固体,反应条件是加热,发生装置可选用A;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式为:2KClO3 ![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)实验室制取CO2,是在常温下用大理石或石灰石和稀盐酸制取的,大理石或石灰石的主要成分是碳酸钙,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2+H2O;选择装置B作为制取CO2气体的发生装置时,大理石或石灰石放在多孔隔板上,稀盐酸从长颈漏斗中加入。反应开始后,关闭开关,气体不能导出,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;打开开关,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。装置B的优点是:可以控制反应的发生和停止;二氧化碳的密度比空气大,若改用F装置收集二氧化碳,则气体应从b进入;制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,要先用NaHCO3溶液除去氯化氢气体(NaHCO3溶液能与氯化氢气体反应生成氯化钠、水和二氧化碳)再通过浓硫酸洗气瓶除去水蒸气(浓硫酸具有吸水性),在除去氯化氢和水蒸气时,为了使气体与试剂充分接触,气体应从长管进短管出。装置正确的连接顺序是:混合气体→e→f→c→d。
-
科目: 来源: 题型:
查看答案和解析>>【题目】星期日爸爸带小凯参观了科技馆,其中“物质之妙”展区蕴含着丰富的化学知识。

(1)A展示了金刚石的微观结构模型。金刚石与石墨的物理性质差异性较大的原因是_______;
(2)B介绍了14C测年法。14C是质子数为6,中子数为8的碳原子,该原子中核外电子数为____;
(3)C介绍了化学家门捷列夫及元素周期表。下图是元素周期表中一部分和元素的原子结构示意图:
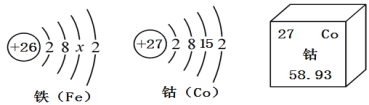
①表中X的值为________;
②钴原子的相对原子质量为_______。
③铁元素、钴元素化学性质相似的原因是___________;
-
科目: 来源: 题型:
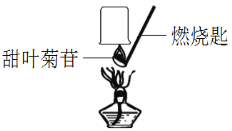
查看答案和解析>>【题目】甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全球最主要的生产国。小晴同学取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置于火焰上方。观察到_______和澄清石灰水变浑浊,由此确定甜叶菊苷中一定含有碳、氢元素。
为了进一步确定其元素组成,利用下图进行实验。(已知:①装置C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳②氢氧化钠可以与二氧化碳反应)
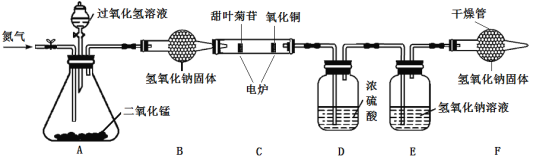
(1)实验前要通一会儿氮气,目的是________。
(2)A装置中发生反应的化学方程式为________。
(3)4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g,E装置增重8.36g。(产物被完全吸收)数据分析:4.02g甜叶菊苷中氧元素的质量为____g,由此可以确定甜叶菊苷是由碳、氢、氧元素组成。
(4)若没有F装置,对氧元素质量测定结果的影响是____(填“偏大”、“偏小”或“无影响”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A~F是初中化学中常见的物质,通常情况下,A、B、E、F是气体,其中E和F的组成元素相同,E有毒性;C和D的组成元素相同且C是相对分子质量最小的氧化物。图中“—”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物以及反应条件已略去。请回答:
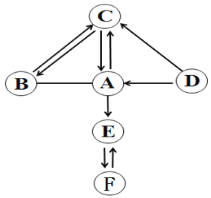
(1)写出C的化学式_______。
(2)物质F的用途是_______。
(3)写出A与B反应的化学方程式:_________。
(4)D → A反应的基本反应类型是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验是科学探究常用的方法。下图是初三化学实验中出现的实验场景,根据下列所示的实验示意图回答问题:

(1)图1实验中发生反应的化学方程式为_____,实验后得出的结论为氧气的含量偏低,可能的原因是___(填一个即可)。
(2)图2实验中,把干燥的紫色纸花和湿润的紫色石蕊纸花分别伸入两瓶干燥的二氧化碳气体中,下列有关说法正确的是___(填序号).
A.CO2与水发反应生成碳酸 B.水具有酸性
C.干燥的紫色石蕊纸花变红 D.湿润的紫色石蕊纸花变红
(3)图3实验中的实验现象为____,为了达到实验的预期结果,实验要在______中进行。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学活动兴趣小组用如图装置进行一氧化碳还原氧化铜的探究实验,反应一段时间后,玻璃管内黑色粉末全部变成红色,澄清石灰水变浑浊。
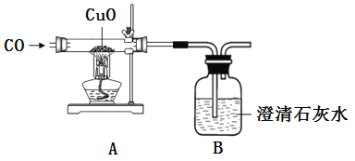
(1)从安全环保的角度考虑,上述实验需要改进的是______。
(2)装置A中发生反应的化学方程式为_____。
(3)同学们通过查阅资料得知:①氧化亚铜(Cu2O)和铜均为红色固体;②铜不与稀硫酸反应,Cu2O能和稀硫酸反应(化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O);③硫酸铜溶液为蓝色。他们对反应后玻璃管中的红色固体进行如下探究:
(提出问题)反应后生成的红色固体成分是什么?
(作出猜想)猜想一:红色固体只有Cu
猜想二:红色固体只有Cu2O
猜想三:红色固体为______。
(实验探究)设计如下实验方案
实验操作
现象
结论
甲同学取少量红色固体于试管中,
加入过量的稀硫酸。
_________
猜想一正确。
乙同学另取少量红色固体于试管中,加入过量的稀硫酸。
溶液变蓝色,有红色固体剩余。
猜想二正确。
(思考与分析)乙同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是________。为此,同学们补充进行了以下实验:称取mg红色固体于试管中,加入过量的稀硫酸充分反应,然后过滤、洗涤、干燥、称量,得到ng固体。当n>______(含m的代数式)时,可以得出猜想三的结论正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取10g石灰石样品,把40g稀盐酸分4次加入样品中(样品中的其它成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥、称量等操作,实验数据如下表:
实验
第一次
第二次
第三次
第四次
稀盐酸的用量
10g
10 g
10 g
10 g
剩余固体的质量
X g
4 g
2 g
2 g
(1)表中X的值 为________g;
(2)该石灰石样品中碳酸钙的质量分数为_______;
(3)计算实验过程中产生二氧化碳气体的质量_______。(写出计算过程)
相关试题

