【题目】水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)自来水的生产过程大体如下图:
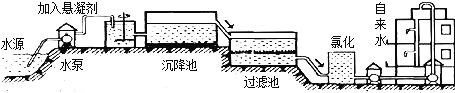
上图过滤池中有活性炭层,活性炭起______作用,该过程中发生_____变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgN03溶液时不宜使用自来水,其原因是(用化学方程式表示)__________________________.高铁酸钾(K2Fe04)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是______.
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是____,当溶液中NaOH的质量分数变为0.2%时,有____水被分解.
参考答案:
【答案】 吸附 物理 AgNO3+HCl=AgCl+HNO3 +6 O2 50.0g
【解析】(1)活性炭具有疏松多孔的结构,能吸附颜色和异味,具有吸附性,该过程中没有生成新物质属物理变化;由于自来水中含有盐酸,盐酸能与硝酸银反应生成氯化银沉淀和硝酸,反应的化学方程式表示为:AgN03+HCl=AgCl↓+HNO3,故不宜使用自来水来配制硝酸银溶液;根据“在化合物中,正负化合价的代数和为零”的原则,已知K的化合价为+1价,O的化合价为-2价,设铁元素的化合价为x,则(+1)×2+x+(-2)×4=0,解得x=+6;(2)电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ;电解过程中溶质氢氧化钠的质量不变,当溶液中NaOH的质量分数变为0.2%,溶液的质量=0.1g/0.2% =50g,那么被电解的水的质量=0.1g+99.9g-50g=50g 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年湖北省孝感市】孝感市有许多优秀的制作工艺,下列工艺中不包含化学变化的是
A.应城石膏的雕刻 B.孝昌臭豆腐的制作
C.孝感米酒的酿造 D.安陆水泥的烧制
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年湖南省长沙市】我们生活在不断变化的物质世界中,下列变化属于物理变化的是( )
A.蜡烛的燃烧 B.二氧化碳使澄清石灰水变浑浊
C.铁钉在潮湿的空气中生锈 D.磁悬浮列车中液氮制冷
-
科目: 来源: 题型:
查看答案和解析>>【题目】国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”,这里的“铁”是指
A.铁元素 B.铁单质 C.氧化铁 D.四氧化三铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】H7N9型禽流感是由H7N9亚型禽流感病毒引起的急性呼吸道传染病,目前治愈率比较低.为预防新型禽流感蔓延,可用ClO2进行环境消毒,制取ClO2的反应过程示意图如图1所示:

请回答下列问题:
(1)如图2所示的四种物质:在a、b、c、d四种物质中属于氧化物的是 (填字母).
(2)a物质中钠、氯、氧原子的个数比是 .
(3)d物质中氯元素和氧元素质量的最简整数比为 .
(4)制取ClO2的化学方程式为 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组利用以下装置探究气体的制取及性质.请结合下图回答有关问题:

(1)写出标号的仪器名称:①__________②__________
(2)实验室用加热高锰酸钾的方法制取氧气,选择的发生装置为__________(填字母),反应的化学方程式为_____________________________,试管口塞一团棉花,其作用是__________;若用C装置来收集一瓶氧气,检验氧气是否集满的方法是______________________________。
(3)实验室用过氧化氢溶液和二氧化锰来制取较纯净的氧气,装置组合是__________(填字母),反应的化学方程式为___________________________________。
(4)氢气是一种密度最小、难溶于水的气体,实验室用颗粒状的锌和稀硫酸在常温下反应即可制得氢气,我们可为其选择的发生装置是__________,收集装置是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素的化学性质主要决定于原子的
A.相对原子质量 B.最外层电子数 C.核电荷数 D.电子层数
相关试题

