【题目】【提出假设】a.Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间.
【查阅资料】在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 .
【实验现象】
金属 | Ti | Mg | Ag |
反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
【实验结论】原假设中 不正确,理由是 .
[结论]用不同浓度的足量稀盐酸反应,是否也能得出同样结论? ,请说明理由
(1)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).
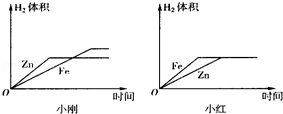
两个图象中存在有错误的是 的图象,判断错误的理由是 ,图象不同的原因是 .
由该实验可以得到的结论:
①金属与酸反应的速率与 有关.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与 有关.
(2)将铁粉加到硫酸铜溶液中,可能观察到的现象有 .
参考答案:
【答案】【实验设计】除去表面的附着物
【实验结论】a;Ti的金属活动性比Mg弱.
[结论]a;Ti的金属活动性比Mg弱
(1)小红;Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应.①金属活动性②相对原子质量(2)产生红色固体,溶液由蓝色变成浅绿色
【解析】【实验设计】
三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的附着物.故填:除去表面的附着物.
【实验结论】
原假设中a不正确,理由是:Ti和稀盐酸反应不如Mg和稀盐酸反应强烈,因此Ti的金属活动性比Mg弱.故填:a;Ti的金属活动性比Mg弱.
[结论]
用不同浓度的足量稀盐酸反应,不能得出同样结论,这是因为反应速率与反应物浓度有关.
故填:不能;反应速率与反应物浓度有关.
(1)两个图象中存在有错误的是小红的图象,判断错误的理由是Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;
图象不同的原因是:小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应.
故填:小红;Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应.
①金属与酸反应的速率与金属活动性有关.故填:金属活动性.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与相对原子质量有关.
(2)将铁粉加到硫酸铜溶液中,可能观察到的现象有产生红色固体,溶液由蓝色变成浅绿色.故填:产生红色固体,溶液由蓝色变成浅绿色.
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是实验室常用的两个气体制备、收集、净化的多种功能装置.

(1)若制备的气体是氢气,则试剂X常用 ,用图示放置的乙装置收集氢气,A应与 (填“B”或“C”)相连.
(2)若制备的气体是氧气,Y是黑色粉末,则甲中反应的化学方程式为 .若A、C相连制取氧气,检验气密性后,还须将装置乙 .
(3)若X是稀盐酸、Y是石灰石,用甲、乙两装置组成发生、净化、收集CO2气体的系列装置.甲中发生的化学反应的化学方程式为: 若乙中放入饱和NaHCO3溶液,该溶液的作用是除去 ;若中放入浓硫酸,浓硫酸的作用是 .
若要检验产生的气体,测乙中应加入的试济为 .反应的化学方程式为: .
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列对一些事实的解释不正确的是
事 实
解 释
A.
用碳素墨水书写档案
常温下单质碳的化学性质稳定
B.
石墨能够做电池的电极材料
石墨较软
C.
焦炭可以把铁从它的氧化物矿石里还原出来
焦炭具有还原性
D.
制糖工业中用活性炭来脱色以制白糖
活性炭具有吸附性
-
科目: 来源: 题型:
查看答案和解析>>【题目】水煤气是重要的气体燃料,某水煤气样品可能含有CO2、CO和H2,某化学兴趣小组的同学对该水煤气样品的成分进行探究.
实验一:(1)将该水煤气样品通入澄清石灰水,若看到 ,证明该气体样品中含有CO2.
实验二:(2)为了证明该水煤气样品中含有CO,小明设计了如图所示装置进行实验,证明该气体样品中含有CO.
请回答:

A中的药品是 ,作用是 ;硬质玻璃管内的黑色粉末是 .
(3)小张认为小明的实验不够严密,做了如下图的改进:则B中澄清石灰水的作用是 ,当观察到 的现象时,可以肯定该水煤气样品中一定含有CO.
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2016年江西省】南昌汉代海昏侯墓出土的文物中,保存较好的玉器非常罕见。对玉石主要成分(化学式为 NaAlSi2O6)的描述正确的是()
A.含有3个氧分子 B.钠元素与铝元素的质量比为23:27
C.钠元素的质量分数为13.4% D.相对分子质量为
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是我们生活中经常用到的一些日用品,它们的水溶液的pH分别列于下表,其中属于酸性物质的是
牙膏
肥皂
食醋
食盐
10
12
4
7
A、牙膏 B、肥皂 C、食醋 D、食盐
-
科目: 来源: 题型:
查看答案和解析>>【题目】某家里蒸馒头用的纯碱中含有少量的氯化钠,某实验小组要测定该纯碱中碳酸钠(Na2CO3)的含量.现取该纯碱样品8g,加入136.7g某稀盐酸溶液恰好完全反应,同时产生了2.2g气体.试计算:
(1)纯碱样品中碳酸钠的质量;
(2)反应后所得氯化钠溶液中溶质的质量;
(3)反应后所得氯化钠溶液的溶质质量分数.
相关试题

