【题目】实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:

【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】
(1)根据受损标签的情况判断,这瓶试剂不可能是__________。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
【得出结论】
(2)小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是_________。
【作出猜想】①可能是__________溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(3)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是____________。
(4)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中, 滴加氢氧化钙溶液 | _____________ | 猜想②正确 相关的化学方程式__________________ |
(5)还可以选择与(4)中不同的试剂确定该溶液,你选择的试剂是_________(要求类别不同),反应的方程式为____________________。
(6) 为了探究一瓶氯化钙溶液的质量分数,取该溶液50g,加入50g碳酸钾溶液,恰好完全反应,所得溶液质量95g,计算此氯化钙溶液的质量分数。__________________
参考答案:
【答案】 A NaHCO3 NaOH NaCl 产生白色沉淀 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 稀盐酸 2HCl+Na2CO3=2NaCl+H2O+CO2↑ 11.1%
【解析】(1)根据酸、碱、盐的组成特点及标签可见部分,猜测该溶液不可能属于哪类物质的溶液;(2)根据溶液中溶质溶解度与饱和溶液中溶质的质量分数的关系,由常温下各物质的溶解度及该溶液中溶质质量分数,判断溶液的可能性;
(3)根据三种物质溶液的酸碱性及所测定溶液的酸碱度,对溶液的可能做出判断;
(4)氢氧化钙溶液与碳酸钠、氢氧化钠溶液是否反应以及反应的化学方程式;
(5)根据碳酸钠、氢氧化钠的性质差异,另选一种试剂完成两种物质的鉴别.
(6)根据氯化钙与碳酸钾反应的化学方程式计算。
解:(1)破损标签可见部分为钠元素,可判断该物质由金属元素与根组成,而酸类物质由氢元素与酸根所组成,可判断该物质不可能为酸;故答案为:A;(2)根据常温下碳酸氢钠的溶液为9.6g,可判断常温下碳酸氢钠的饱和溶液的溶质质量分数=![]() ,因此可判断该溶液不可能为碳酸氢钠溶液;故答案为:NaHCO3。
,因此可判断该溶液不可能为碳酸氢钠溶液;故答案为:NaHCO3。
(3)由于氢氧化钠、碳酸钠溶液都为碱性,溶液pH都大于7,只有氯化钠溶液的pH=7,所以该瓶pH大于7的溶液不可能是氯化钠溶液;故答案为:NaCl;
(4)氢氧化钙溶液与碳酸钠溶液反应,生成白色沉淀,反应的化学方程式:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(5)根据碳酸钠能与盐酸反应放出二氧化碳而氢氧化钠与盐酸反应无明显现象,因此,可推断鉴别两物质时所加入的试剂为稀盐酸,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,观察有气泡可说明该物质为碳酸钠,把产生气体通入澄清石灰水,石灰水会变浑浊,反应的化学方程式为2HCl+Na2CO3=2NaCl+H2O+CO2↑;故答案为:稀盐酸;2HCl+Na2CO3=2NaCl+H2O+CO2↑.
(6)解:设原溶液中CaCl2的质量为x。
CaCl2+K2CO3═CaCO3↓+2KCl
111 100
x (50g+50g-95g)
![]()
x═5.55g
则溶液中中CaCl2的质量分数为:![]()
答:所用CaCl2溶液的质量分数11.1%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】决定元素种类的是原子的
A.质子数 B.中子数 C.电子数 D.最外层电子数
-
科目: 来源: 题型:
查看答案和解析>>【题目】现配制溶质质量分数为5%的NaCl溶液,下列说法正确的是 ( )
A.将氯化钠固体直接放在天平的托盘上称量
B.配制溶液的烧杯留有水
C.为加快固体溶解,用温度计搅拌
D.将配好的溶液倒入细口瓶中,塞紧瓶塞并贴上标签
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定条件下,在一个密闭器内发生某反应,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
物质
CO2
O2
H2O
W
反应前质量(g)
6
58
5
23
反应后质量(g)
X
10
32
0
A. 该反应属于化合反应
B. W是一种由碳、氢两种元素组成的化合物
C. W是一种由碳、氢、氧三种元素组成的化合物
D. X的值为44
-
科目: 来源: 题型:
查看答案和解析>>【题目】以下是研究实验室制取氧气的装置图,请按要求回答下列问题.
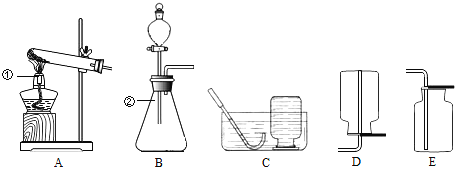
⑴写出图中标号仪器的名称:① _________;②_____________。
⑵实验室用氯酸钾制取氧气,应选用的发生装置是_________,(填字母序号,下同),若要收集一瓶干燥的A氧气,应选择的收集装置是__________ 。
⑶实验室用H2O2溶液和MnO2混合制氧气,其中MnO2起_________作用,该反应的化学方程式为______________。
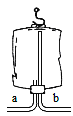
⑷若用下图所示医用塑料袋排空气法收集H2,则H2导入端为____(填“a”或“b”)
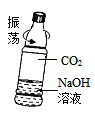
(5)用下图所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,CO2与NaOH溶液反应的化学方程式为____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】消防使用风力灭火机可以喷出类似十二级台风的气流将火吹灭,它灭火原理是( )
A. 隔绝空气 B. 吹走可燃物 C. 降温到着火点以下 D. 降低可燃物着火点
-
科目: 来源: 题型:
查看答案和解析>>【题目】在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持仪器已略去),引起同学们的兴趣.如图是四位同学对实验中的部分现象进行的预测,预测正确的是
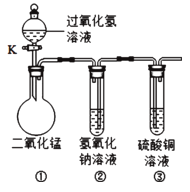
A. 打开活塞K,装置①中会有气泡冒出,黑色固体消失
B. 打开活塞K,装置②中会看到液面上升,产生蓝色沉淀
C. 打开活塞K,装置②中会有气泡冒出
D. 打开活塞K,装置③中会有液体流入,产生蓝色沉淀
相关试题

