【题目】二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组对此展开了系列研究。
Ⅰ.用高锰酸钾制备
资料一:(1)3K2MnO4+ 2H2SO4=2KMnO4+MnO2↓+2K2SO4+2H2O
(2)K2MnO4易溶于水
实验室加热高锰酸钾制氧气,反应的化学方程式为_____________,其反应类型是_______。将反应后的固体剩余物用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2。用稀硫酸而不用水浸取的原因是____________。
Ⅱ.用硫酸锰制备
电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,该反应的化学方程式为______,一段时间后溶液的pH将_______(填“变大”、“变小”或 “不变”)
Ⅲ.用废锂电池制备
资料二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
用废锂电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)制备纳米MnO2,并进行锂资源回收,流程如下:
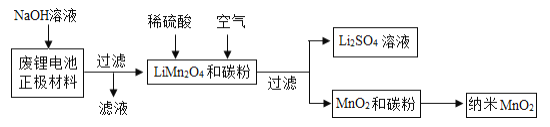
请回答下列问题:
(1)“滤液”中溶质的主要成分是________ (填化学式)。
(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和______。
(3)MnO2与碳粉经下列三步反应制得纳米MnO2:
① 2MnO2+C![]() 2MnO+CO2↑
2MnO+CO2↑
② MnO+H2SO4=MnSO4+H2O
③ 3MnSO4+2KMnO4+2H2O=5MnO2↓+K2SO4+2H2SO4
上述涉及元素化合价变化的反应有_______(填序号)。
IV.用碳酸锰制备
控制一定的温度,焙烧MnCO3制取MnO2的装置如下:
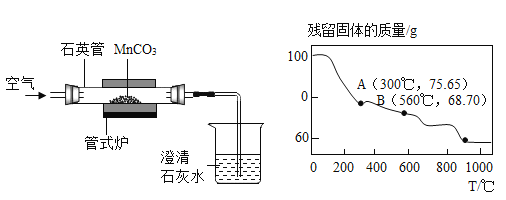
(1)实验中观察到澄清石灰水变浑浊,写出石英管中发生反应的化学方程式___________。
(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如上图所示。图中B点对应固体成分的化学式为______(请写出计算过程)。
参考答案:
【答案】 2KMnO4![]() K2MnO4+MnO2+O2↑ 分解反应 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰 2H2O+MnSO4通电H2↑+H2SO4+MnO2↓ 变小 NaAlO2 玻璃棒 ①③ MnCO3高温CO2↑+MnO2 Mn2O3
K2MnO4+MnO2+O2↑ 分解反应 使锰酸钾转化得到二氧化锰,获得更多的二氧化锰 2H2O+MnSO4通电H2↑+H2SO4+MnO2↓ 变小 NaAlO2 玻璃棒 ①③ MnCO3高温CO2↑+MnO2 Mn2O3
【解析】Ⅰ、实验室加热高锰酸钾制氧气是高锰酸钾在加热的条件下生成锰酸钾和二氧化锰以及氧气,对应的化学方程式为 2KMnO4![]() K2MnO4+MnO2+O2↑;形式上为一变多,为分解反应;根据信息提示“32H2O+MnSO4通电H2↑+H2SO4+MnO2↓”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;Ⅱ、电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,反应物为硫酸锰和水,条件是通电,生成二氧化锰和氢气以及硫酸,对应的化学方程式为 2H2O+MnSO4通电H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将 变小;Ⅲ、(1)“滤液”中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是 NaAlO2(还可能有剩余的NaOH;(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和 玻璃棒;(3)MnO2与碳粉经下列三步反应制得纳米MnO2:单质中元素的化合价为零,化合物中元素的化合价的代数和为零,①MnCO3高温CO2↑+MnO2,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素由+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变.上述涉及元素化合价变化的反应有 ①③;IV、(1)实验中观察到澄清石灰水变浑浊,说明生成了二氧化锰和二氧化碳,对应的化学方程式 MnCO3高温CO2↑+MnO2;(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示.样品100g在图中B点对应固体的质量为68.70g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×
K2MnO4+MnO2+O2↑;形式上为一变多,为分解反应;根据信息提示“32H2O+MnSO4通电H2↑+H2SO4+MnO2↓”,将反应后的固体剩余物(锰酸钾和二氧化锰的混合物)用稀硫酸浸取一段时间后过滤、洗涤、烘干即得MnO2,使锰酸钾转化得到二氧化锰,获得更多的二氧化锰,所以用稀硫酸而不用水浸取;Ⅱ、电解MnSO4溶液可制得活性MnO2,同时生成氢气和硫酸,反应物为硫酸锰和水,条件是通电,生成二氧化锰和氢气以及硫酸,对应的化学方程式为 2H2O+MnSO4通电H2↑+H2SO4+MnO2↓,由于水越来越少,硫酸越来越多,也就是酸的质量分数变大,所以酸性越来越强,而pH越来越小,所以一段时间后溶液的pH将 变小;Ⅲ、(1)“滤液”中存在可溶性物质,而废旧锂电池正极材料和氢氧化钠溶液反应,根据信息“2Al+2NaOH+2H2O═2NaAlO2+3H2↑”,可知生成了偏铝酸钠,所以溶质的主要成分是 NaAlO2(还可能有剩余的NaOH;(2)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和 玻璃棒;(3)MnO2与碳粉经下列三步反应制得纳米MnO2:单质中元素的化合价为零,化合物中元素的化合价的代数和为零,①MnCO3高温CO2↑+MnO2,有单质参与反应,所以有化合价改变;②MnO+H2SO4═MnSO4+H2O,为复分解反应,无化合价改变;③3MnSO4+2KMnO4+2H2O═5MnO2↓+K2SO4+2H2SO4,硫酸锰中的锰元素由+2变化+4价,而高锰酸钾中的锰元素由+7价变为+4价,所以有化合价的改变.上述涉及元素化合价变化的反应有 ①③;IV、(1)实验中观察到澄清石灰水变浑浊,说明生成了二氧化锰和二氧化碳,对应的化学方程式 MnCO3高温CO2↑+MnO2;(2)MnCO3在空气中加热易转化为锰的不同氧化物,其残留固体质量随温度的变化如图所示.样品100g在图中B点对应固体的质量为68.70g,而过程中锰元素的质量不变,100g碳酸锰中锰元素的质量为100g×![]() ,则B点物质含氧元素的质量为68.70g﹣100g×
,则B点物质含氧元素的质量为68.70g﹣100g×![]() ,在固体中锰原子和氧原子个数比为:
,在固体中锰原子和氧原子个数比为:
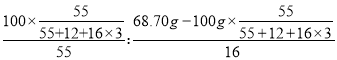 ≈2:3;则固体成分的化学式为Mn2O3。
≈2:3;则固体成分的化学式为Mn2O3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图所示的溶解度曲线,判断下列说法正确的是
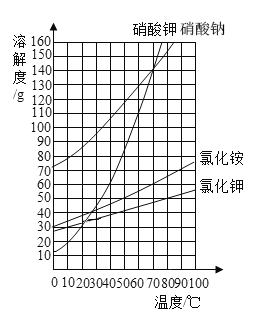
A. 50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B. 60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃,剩余晶体的质量氯化钾多
C. 70℃时,50g硝酸钠饱和溶液与100g硝酸钾饱和溶液中所含溶剂质量之比为1:2
D. 80℃时,向100g氯化钾饱和溶液中加入150g硝酸钠,充分搅拌后,最终得到250g溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】为验证“加热碳酸氢铵”所发生的变化,两同学分别用甲、乙所示装置进行实验,发现两实验中碳酸氢铵固体均消失,乙实验中还观察到无水硫酸铜变蓝、浸有酚酞试液的棉球变红、澄清石灰水变浑浊。
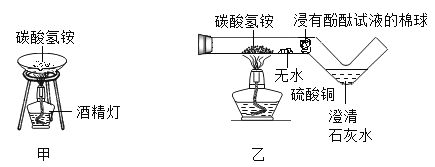
资料:无水硫酸铜呈白色,遇水后呈蓝色。
下列说法错误的是
A. 甲实验不如乙实验环保
B. 只根据甲实验“固体消失” 这一现象,可验证碳酸氢铵发生了分解
C. 乙实验有利于学生分析“固体消失” 的原因
D. 只根据乙实验的现象,可验证NH4HCO3
 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O -
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,人类的衣、食、住、行都离不开化学。
(1)在厨房里蕴藏着许多化学知识。
①下列食物中,能提供大量维生素的是________________(填字母)。
②加铁酱油中的“铁”是指______(填“元素”或“原子”), 身体缺铁会引起贫血。
③厨房中能用来除水垢的物质是____________。
④为防止菜刀生锈,可采用的一种措施是__________。
(2)汽车、高铁、飞机等已成为人们出行的常用交通工具。
①汽油是汽车常用的一种燃料。将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于______变化。汽车的铅蓄电池工作时,发生如下化学反应:Pb+bO2+2H2SO4=2PbSO4+2H2O该反应涉及的物质中属于氧化物的有__________。
②高铁车头的玻璃是用无机玻璃、树脂、塑料等粘合而成,能耐受强大的撞击力,这种玻璃属于___________(填字母)。
A.复合材料 B.合成材料 C.金属材料·
③制造飞机使用了硬铝(铝铜镁硅合金),其中镁元素的某种粒子结构示意图为
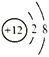 ,镁原子的最外层电子数是___________。
,镁原子的最外层电子数是___________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答有关问题。
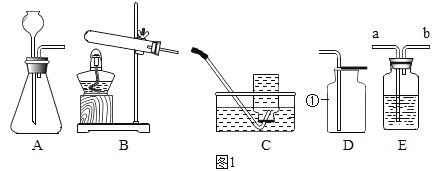
(1)图中标有①的仪器名称__________。
(2)实验室用大理石与稀盐酸反应制取二氧化碳,选用的发生装置是______(填字母),装入药品前应进行的操作是_____________。若要收集干燥的二氧化碳,需将发生装置与装置E和装置______(填字母) 相连,其中装置E内的试剂是___________,气体应从导管_____(填“a”或“b”)端通入。
(3)在2017年江苏省中学化学创新实验调演中,李彬老师设计了“氢氧焰”的实验装置如下:
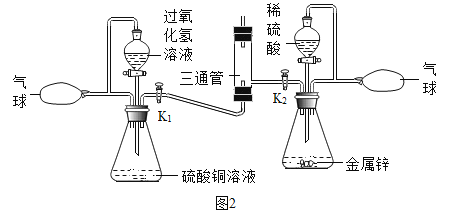
利用氢气与要求的发生装置制取并储存纯净的气体于气球中。A瓶中硫酸铜溶液的作用是______,B瓶中产生气体的化学方程式为_________________。通过玻璃活塞K1、K2分别有序控制氧气和氢气的流量,先后进行如下操作:
①关闭K2,打开K1,通入氧气,将带火星的木条置于三通管口处,观察到_____,说明氧气具有助燃性。将燃着的术条移开,.管口处无火焰。
②关闭K1,打开K2,通入氢气,将燃着的木条置于三通管口处,管口处有火焰。移去燃着的木条,氢气安静地燃烧,说明氢气具有可燃性,该反应的化学方程式为_______。把铁片放在火焰上一段时间,铁片呈红热状。打开K1,通入氧气,铁片迅速熔断被切割,由此得出的结沦是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅酸钠(Na2SiO3)是我国优先发展的精细化学品。用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)制备硅酸钠(Na2SiO3)的流程如下:
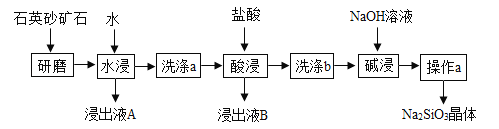
资料:SiO2既不溶于水,也不与盐酸反应。
请问答下列问题:
(1)“研磨”的目的是_______ 。
(2)检验“洗涤a”已洗净的方法是____________。
(3)“酸浸”的化学方程式为____________。
(4)“碱浸”的化学方程式为____________。
(5)“操作a”包含蒸发浓缩、_____ 、过滤、洗涤、干燥等一系列操作。
-
科目: 来源: 题型:
查看答案和解析>>【题目】从用石灰浆抹的墙壁上掉下一块白色固体,为探究其成分,进行如下实验:

由此得出的结论正确的是 ( )
A. 一定有CaCO3和Ca(OH)2
B. 一定有Ca(OH)2,可能有CaCO3
C. 一定没有CaCO3和Ca(OH)2
D. 一定有CaCO3,可能有Ca(OH)2
相关试题

