【题目】(6分)为测定氯化钠和碳酸钠混合物的组成情况,某研究小组进行了如下实验。
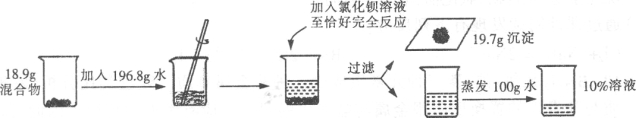
请回答下列问题:
(1)实验中发生反应的化学方程式为
(2)求解混合物中发生反应物质的质量(x)的比例式为
(3)混合物中氯化钠和碳酸钠质量的最简整数比为 。
(4)在滴加氯化钡溶液的过程中,烧杯中各溶质质量的变化情况为
(5)所用氯化钡溶液中溶质质量分数为 。
参考答案:
【答案】(1)Na2CO3+BaCl2==BaCO3↓+2NaCl
(2)106/197=x/19.7g
(3)83:106
(4)碳酸钠减少至消失,氯化钠增多
(5)20%
【解析】
试题分析:(1)向氯化钠和碳酸钠的溶液中加入氯化钡溶液,氯化钡会与碳酸钠反应生成碳酸钡沉淀和氯化钠:Na2CO3+BaCl2==BaCO3↓+2NaCl ;
(2)根据提供的数据可知,碳酸钠与氯化钡反应最终生成的沉淀的质量为19.7g,那么可以根据生成的沉淀的质量计算出碳酸钠的质量。
设碳酸钠的质量为x,那么:
Na2CO3+BaCl2==BaCO3↓+2NaCl
106 197
X 19.7g
106/197=x/19.7g
X=10.6g
(3)氯化钠和碳酸钠混合物的总质量为18.9g,那么氯化钠的质量=18.9g-10.6g=8.3g,
故混合物中氯化钠和碳酸钠质量的比=8.3:10.6=83:106 ;
(4)在滴加氯化钡溶液的过程中,由于碳酸钠会与氯化钡反应生成氯化钠,故碳酸钠的质量减小,氯化钠的质量增加;
(5)利用化学方程式,根据反应的质量比可计算出氯化钡溶液中溶质的质量和生成了氯化钠的质量。
设氯化钡溶液中溶质的质量为y,生成的氯化钠的质量为z,
Na2CO3+BaCl2==BaCO3↓+2NaCl
208 197 117
Y 19.7g z
208/197=y/19.7g 117/197=z/19.7g
Y=20.8g z=11.7g
反应后的溶液中溶质氯化钠的质量=8.3g+11.7g=20g
根据溶液蒸发水前后溶质的质量不变,那么设原溶液的质量为a ,那么:
20g/(a-100g) ×100% =10%
a=300g
那么加入的氯化钡溶液的质量=300g-(18.9g+196.8g-19.7g)=104g
故加入的氯化钡溶液的溶质质量分数=20.8g/104g ×100%=20%
答:略
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质的溶解度曲线,下列说法不正确的是

A.t1℃时,甲、乙两种物质的溶解度相等
B.若固体甲中含有少量乙时可用蒸发结晶方法提纯甲
C.t2℃用等质量的甲、乙两种物质配制甲、乙的饱和溶液需要水的质量甲小于乙
D.已知t2℃甲的溶解度为50g,在t2℃时将50g甲物质加入到50g 水中,充分溶解得到75g溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列符号能表示两个氮原子的是
A.N2 B.2N C.2N2 D.N2O4
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列做法正确的是
A.电器着火用水扑灭 B.室内起火时打开门窗通风
C.油锅着火用锅盖盖灭 D.用明火检查液化气罐是否漏气
-
科目: 来源: 题型:
查看答案和解析>>【题目】(6分)实验室现有氯酸钾、稀盐酸、二氧化锰、火柴及以下仪器:
(1)若补充一种药品 (填名称),可以制取一种气体A。若补充一种仪器 (填名称),还能制取另一种气体B,反应的化学方程式是 。
(2)将导管伸入集气瓶收集气体B时,当集气瓶中的水排完后,应在 ,小心的把集气瓶移出,正放在桌面。检验气体B时,将 插入盛有气体B的集气瓶中,观察现象。
(3)下图是滨滨同学绘制的实验室制取二氧化碳的装置图,请帮助他补充完整。
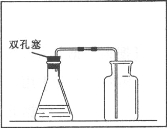
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活中常用铁锅炒菜,主要利用铁的
A.导电性 B.导热性 C.延展性 D.有金属光泽
-
科目: 来源: 题型:
查看答案和解析>>【题目】决定元素种类的是
A.质子数 B.电子数 C.中子数 D.最外层电子数不同
相关试题

