【题目】铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
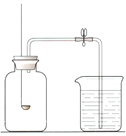
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。

编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2 mL浓硫酸 | 铜片始终无明显变化 |
2 | 先加入4 mL饱和Na2SO3溶液 再充满CO2 | 铜片始终无明显变化 |
3 | 加入2 mL NaOH浓溶液 | 铜片始终无明显变化 |
4 | 先加入2 mL浓硫酸 再通入约4 mL CO2 | 铜片始终无明显变化 |
5 | 先加入2 mL蒸馏水 再通入约4 mL CO2 | 铜片表面变成绿色 |
【解释与结论】
(1)实验中,NaOH浓溶液的作用是________(用化学方程式表示)。
(2)实验1的目的是________。
(3)实验2中,试管内的气体主要含有CO2、________。
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是________(填编号)。
(5)由上述实验可推知,铜片生锈的条件是________。
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是________。
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,即可得出铜生锈与空气中的二氧化碳有关。他们的依据是________。
参考答案:
【答案】 2NaOH+CO2=Na2CO3+H2O 探究Cu只与O2接触是否会生锈 H2O 4、5 Cu与H2O、CO2、O2同时接触 常温下氮气的化学性质不活泼,很难和其他物质反应 质量守恒定律
【解析】(1)实验中,NaOH浓溶液要将空气中二氧化碳除去,形成对照,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)先充满用NaOH浓溶液洗涤过的空气,除去了二氧化碳,再加入2 mL浓硫酸除去了水分,所以探究探究Cu只与O2接触是否会生锈;
(3)常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。先加入4 mL饱和Na2SO3溶液,除去O2,再充满CO2,试管内的气体主要含有CO2、水蒸气、氮气等,但是氮气与铜锈是无关;
(4)4实验先加入2 mL浓硫酸,再通入约4 mL CO2与5实验先加入2 mL蒸馏水,再通入约4 mL CO2唯一变量是水,对照得出“铜生锈一定与H2O有关”的结论。
(5)通过上述实验可以得出铜生绣的条件是与水、氧气和二氧化碳共同反应;
(6)常温下氮气的化学性质不活泼,很难和其他物质反应,所以铜生锈与N2无关;
(7)向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,说明生成了二氧化碳,由质量守恒定律,反应前后元素的种类不变,可知铜锈含有碳元素,即可得出铜生锈与空气中的二氧化碳有关。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在空气中放置较长时间的铜片,表面会形成一层薄膜,其中含有Cu2(OH)2CO3。若该物质通过化合反应生成,反应物除了Cu外,还有N2、O2、CO2、H2O中的
A.一种 B.两种 C.三种 D.四种
-
科目: 来源: 题型:
查看答案和解析>>【题目】除去下列物质中的余质所选用的试别及操作方法不正确的一组是 ( )
物质
所含杂质
除去杂质的方法
A
N2
O2
将气体缓缓通过灼热的铜网
B
KCl
MnO2
溶解、过滤、蒸发
C
CuO
Cu
稀硫酸、过滤
D
KOH溶液
K2CO3
适量Ca(OH)2溶液、过滤
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】用如图所示装置,在常温下,分别进行研究空气中氧气含量和研究燃烧条件的实验。
已知:白磷的着火点为 40℃。
内容
【实验 1】测定空气中氧气含量
【实验 2】研究燃烧条件
实验步骤
燃烧匙中放足量白磷,烧杯中盛放足量水,用激光手电照射白磷,白磷燃烧起来。待白磷熄灭冷却至室温后,打开弹簧夹,观察到
________。
向广口瓶中加入少量二氧化锰,烧杯中盛有 80℃的热水,
在烧杯中导管口放置一小块白磷,塞紧瓶塞用注射器向瓶中注入适量H2 O2 溶液
(1)实验前检查装置气密性:打开弹簧夹,向烧杯中加水至液面浸没下端导管口,用手捂住广口瓶瓶外壁,说明装置的气密性良好的现象是________。
(2)补全实验1中的实验现象________。
(3)实验2中,推入 H2O2 溶液后,瓶内发生反应的化学方程式为________,实验过程中,能说明可燃物燃烧需要氧气的实验现象是________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在氯化铜和氯化镁的混合溶液中加人过量铁粉,充分反应后过滤,留在滤纸上的是( )
A. Fe 和 Cu B. Mg和Cu C. Fe D. Cu
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列操作或现象与分子对应的特性不一致的选项是
选项
操作或现象
分子的特性
A
给篮球充气
分子间有间隙
B
物质热胀冷缩
分子大小随温度改变而改变
C
在花园中可闻到花的香味
分子是运动的
D
加热氧化汞可得到金属汞和氧气
分子在化学变化中是可以再分的
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面科普短文(原文作者:龙门、宋野等,原文有删改)
咸鸭蛋是人们常用的一种食品,咸鸭蛋黄还是制作粽子、点心等食品的材料。咸鸭蛋中富含锌、钙,对儿童身体及骨骼的生长有帮助,并能在一定程度上预防贫血。
资料1:腌制原理
咸鸭蛋在腌制过程中,食盐通过蛋壳及蛋壳膜不断向蛋内渗透,虽然没有改变蛋白质及脂肪的成分,但却改变了蛋白中蛋白质的特性及蛋黄中脂质含量。
资料2:腌制过程
腌制鸭蛋一般经过以下几个步骤:鲜蛋→检验(照蛋)→洗蛋→晾干→放入食盐水溶液中装罐→腌制。一般腌制30天,就能得到味美的咸鸭蛋。资料显示,将晾干后的鲜鸭蛋放入1%的盐酸溶液中浸泡10分钟,蛋壳(主要成分是CaCO3)与盐酸溶液发生反应,蛋壳表面的毛孔增大。放入饱和的食盐水中,溶液更易通过蛋膜进入蛋清,只需7天左右就可腌制出合格的咸蛋(蛋内的食盐含量及蛋黄内的油脂含量均达到国家标准),且口感很好。
资料3:影响咸鸭蛋品质的因素
咸鸭蛋的蛋黄指数是鸭蛋品质的一个重要指标。一般情况下,蛋黄指数越高,品质越好。不同腌制条件对蛋黄指数的影响如下所示。

资料4:咸鸭蛋的食用
咸鸭蛋与鲜蛋的营养价值基本相同,但咸鸭蛋中钠、钙、铁、硒等矿物质元素含量比鲜鸭蛋高。特别是含钠量高,折算成含盐量,每只咸蛋含盐在6g以上。长期高盐摄取是造成高血压、胃粘膜受损等疾病的原因。
依据文章内容,回答下列问题。
(1)鲜鸭蛋及咸鸭蛋中均含锌、钙,“锌”“钙”指的是________(填“分子”、“原子”
或“元素”)。
(2)请写出蛋壳和盐酸反应的化学方程式__________。
(3)影响咸鸭蛋品质的因素有_____________。
(4)当腌制温度为25℃、腌制时间为30天时,用盐量为_____g/(100g),咸鸭蛋品质最高。
(5)请写出一条食用咸鸭蛋的建议_____________。
相关试题

