【题目】有一包不纯的Na2CO3粉末,其中的杂质可能是Cu (NO3)2、K2CO3、Na2SO4、Ba(NO3)2、NaCl、CaCO3中的一种或几种。
(1)取样,加足量水溶解,过滤得白色固体A和无色滤液B。则粉末中一定不含_______。
(2)在A中加足量稀HNO3,白色固体A部分溶解,则此粉末中一定含的杂质是_______、_______。
(3)取适量无色滤液B,先加入过量_____溶液,再加入AgNO3溶液,可判断此粉末中是否含NaCl。
(4)取21.2g粉末,加足量稀盐酸,充分反应生成CO2气体8.8g。则原粉末中一定含_______(填“K2CO3”或“CaCO3”)。
参考答案:
【答案】 Cu(NO3)2 Na2SO4 Ba(NO3)2 Ba(NO3)2 CaCO3
【解析】有一包不纯的Na2CO3粉末,其中的杂质可能是Cu (NO3)2、K2CO3、Na2SO4、Ba(NO3)2、NaCl、CaCO3中的一种或几种。
(1)取样,加足量水溶解,过滤得白色固体A和无色滤液B;则粉末中一定没有Cu (NO3)2;白色沉淀可能是CaCO3、BaCO3及BaSO4中的一种或多种;
(2)在A中加足量稀HNO3,白色固体A部分溶解,说明A中一定含有BaSO4,而CaCO3、BaCO3中至少有一种或二种,则此粉末中一定含的杂质是Na2SO4、Ba(NO3)2 ;
(3)取适量无色滤液B,先加入过量稀硝酸溶液酸化,再加入AgNO3溶液,如有AgCl白色沉淀生成,可判断此粉末中含NaCl,否则不含NaCl;
(4)取21.2g粉末,加足量稀盐酸,充分反应生成CO2气体8.8g,若只有碳酸钙,设碳酸钙质量为x,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 8.8
![]() ,解得:x=20g<21.2g,假设成立;
,解得:x=20g<21.2g,假设成立;
若只有碳酸钾,设碳酸钾质量为y,则:
K2CO3+2HCl=2KCl+CO2↑+H2O
138 44
y 8.8
![]() ,解得:y=27.6g>21.2g,假设不成立;
,解得:y=27.6g>21.2g,假设不成立;
故原粉末中一定含CaCO3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示某些物质间的转化关系。A是大理石的主要成分,75%的Z溶液是一种常用医用消毒剂,反应③是自然界中最重要的反应,漂白粉的主要成分为氯化钙和次氯酸钙【Ca(ClO)2】,X的化学性质与碳酸氢钠相似。
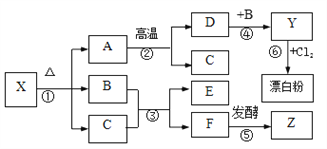
(1)化学式:X_______ ,Z________;
(2)反应③、⑥的化学方程式:
反应③________,反应⑥___。
(3)反应④为______(选填“放热”或“吸热”)反应。
(4)工业上可用C和NH3合成尿素【CO(NH2)2】和水,反应中C和NH3的质量比为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列对物质的归类不正确的是
选 项
归 类
物 质
A
化石燃料
煤、石油、天然气
B
合成材料
电玉、蚕丝、铝合金
C
营养物质
糖类、油脂、维生素
D
空气污染物
二氧化硫、一氧化碳、二氧化氮
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会联合发布了113号、115号、117号和118号元素的中文名称。不同种元素最本质的区别是
A. 质子数不同 B. 中子数不同
C. 最外层电子数不同 D. 相对原子质量不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种物质的溶解度曲线如图所示。下列说法不正确的是
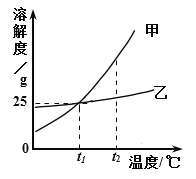
A. t2℃时,甲的溶解度大于乙的溶解度
B. t1℃时,甲、乙两种溶液的溶质质量分数一定不大于20%
C. t2℃时,甲溶液的溶质质量分数不一定大于乙溶液的溶质质量分数
D. t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
-
科目: 来源: 题型:
查看答案和解析>>【题目】生产、生活中处处有化学。
(1)食用米饭、馒头,主要为人体补充的营养素是____________________。
(2)碘酒是家庭常备药,碘酒中的溶剂是__________________。
(3)施用磷肥可以提高农作物的抗寒抗旱能力。磷矿粉是常用的磷肥,其主要成分磷酸钙〔Ca3(PO4)2〕中磷元素的化合价为______________。
(4)汽车使用乙醇汽油做燃料,可以节约化石燃料,也减少对空气的污染。乙醇在空气中燃烧的化学方程式为__________________________________________。
(5)在医疗上,碳酸氢钠是治疗胃酸(含有盐酸)过多症的一种药剂。请写出有关的化学方程式________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图所示的实验回答问题。
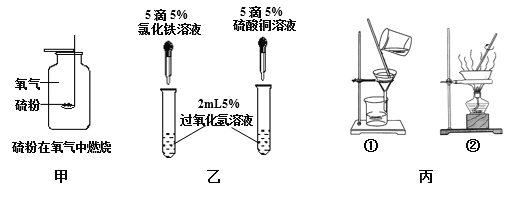
(1)指出甲实验的不足之___________________。
(2)已知氯化铁溶液、硫酸铜溶液均可做过氧化氢制氧气的催化剂。乙实验的目的是__________________________;
请写出乙实验中反应的化学方程____________________。
(3)丙实验①、②是粗盐提纯实验中的两步,做完步骤①后,滤液仍然浑浊,其原因可能是_______________;步骤②中,当观察到________时,停止加热。
相关试题

