【题目】石灰石是生产玻璃、氯化钙等多种化工产品的原料。某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 | 1 | 2 | 3 | 4 |
加入样品质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)第几次反应中矿石有剩余?_________;
(2)表中m值是________;
(3)试计算这种石灰石中碳酸钙的质量分数为_________。
参考答案:
【答案】 略 略 略
【解析】试题分析:(1)根据表格中前两次的数据分析可知,每加入5g样品,生成CO2的质量为1.76g;故第3次加入15g样品后,应该生成CO2的质量为1.76g×3=5.28g,而实际只有4.4g,说明此时盐酸已完全反应,故第3、4次实验中碳酸钙有剩余。
(2)因为第3次盐酸已完全反应,不再有气体产生,故第4次反应生成的气体质量和第3次的一样多,即m=4.4。
(3)根据第1次或第2次实验中二氧化碳的质量,结合化学方程式中二氧化碳与碳酸钙的质量比,即可求出参加反应的CaCO3的质量,再根据质量分数公式进行计算即可。
解,设第1次实验中样品中的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g
100:44 =x:1.76g
解得,x=4g
所以,石灰石中碳酸钙的质量分数为![]() ×100%=80%
×100%=80%
答:石灰石中碳酸钙的质量分数为80%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】取一块废旧铁丝网,将铁丝网剪成几小片,用________除去铁锈后,放入________中,如图所示,再加入3~4 mL浓________,塞紧带导管的单孔塞后,将导管的另一端伸入滴有红墨水的水中,过一段时间后观察现象:锥形瓶中铁丝表面有___________生成;导管中有一段__________。滴入红墨水的原因是_____________________________________。通过实验观察并根据实验现象分析,与铁生锈相关的主要因素是________(填序号)。
A.空气 B.太阳光 C.盐酸 D.红墨水

-
科目: 来源: 题型:
查看答案和解析>>【题目】碳酸氢铵是常用的化肥,它是一种________色的________状________体,将它放入________(填仪器名称)中加热,加热片刻后,可以看到____________________________,在仪器口可闻到一股__________的气味,说明有________产生。除此,碳酸氢铵加热还产生了________、________两种物质。由此,我认为碳酸氢铵应注意______保存于________之处。
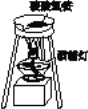
-
科目: 来源: 题型:
查看答案和解析>>【题目】小华在吃黄花鱼时,看到其头骨上有两块白色的小石头。
[提出问题]这白色小石头中含有什么物质?
[查阅资料]小石头被称为“鱼脑石”,用来控制鱼在水中的沉浮。
[猜想与假设]如图

[供选试剂] 10%稀盐酸,澄清石灰水,10%氢氧化钠溶液,紫色石蕊试液,酚酞试液。
[进行实验] 验证小力的猜想。
实验方法
可能看到的现象
结 论
①取粉碎后的“鱼脑石”加入_______
②________
①_____________
②______________
_______
[反思] 如果实验证明了小力的猜想是正确的,你认为“鱼脑石”中一定含碳酸钙吗?简述理由。____________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂。古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾。写出与制氢氧化钾有关的化学方程式,并注明反应类型。
(1)________________________________(________)反应
(2)________________________________(________)反应
(3)________________________________(________)反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】用化学用语填空:
(1)三个氢原子_______;(2)+2价的镁元素________;
(3)相对分子质量最小的氧化物_____;(4)三个铁离子___________;
(5)空气中含量最多的气体______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图回答有关问题。
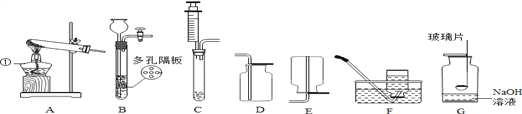
(1)写出图中标号仪器名称:①_____________;它的用途是______________。
(2)实验室用高锰酸钾制取氧气应选用的发生装置是____(填序号,下同),收集装置是_____,该方法是利用氧气的______________性质。若用F装置收集氧气需要改进的是______________,反应的化学符号表达式为_______________________.检验装置气密性时,除了用手紧握的方法外,还可以采用的方法是________________________;
(3)小敏同学用收集到的氧气做了细铁丝的燃烧实验,取得了成功,其反应的化学符号表达式为___________________________。
(4)发生装置B的优点是__________________,用该装置制取二氧化碳,反应的化学符号表达式为_____________________________。实验室可用氧化钙固体与浓氨水在常温下混合制取少量氨气,为了得到平稳的氨气流,应选择的发生装置是____。
(5)用G装置做硫在氧气中燃烧实验,燃烧结束后取出燃烧匙,立即用玻璃片盖住瓶口并振荡,若将集气瓶倒转,发现玻璃片被“吸住”而不掉下来(如甲图),其原因是__________________;
相关试题

