【题目】小明拿起家中的水壶准备煮水时,发现壶内有些褐色的固体。为了探究其成分,与兴趣小组同学查阅资料后获知这些褐色的固体是水垢,它可能是因为水中含有Ca(HCO3)2和Mg(HCO3)2等可溶性物质在加热时生成了CaCO3和Mg(OH)2。
(1)含有较多Ca(HCO3)2的水称_____(填“硬水”或“软水”),加热时发生反应的化学方程式为__________。
(2)小明认为本市属喀斯特地貌,以石灰岩为主,该水垢的成分只有CaCO3;但小白不同意,认为也可能只有Mg(OH)2,还可能______________。
(3)小明为了证明自己的猜想,设计如下实验方案:
实验操作 | 现 象 | 结 论 |
①取少量水垢于试管中,加入过量的_______。 | 观察到现象_________, 反应的化学方程式__________。 | 水垢中有CaCO3 |
②向①反应后的试管中滴加2-3滴NaOH溶液 | 观察到现象__________。 | 水垢中没有Mg(OH)2, 我的猜想成立 |
(4)小白不认可小明的结论,认为他的实验操作有缺陷,原因是_________________________。
参考答案:
【答案】 硬水 Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑ CaCO3和Mg(OH)2 稀盐酸(或稀HNO3) 固体溶解(消失),有气泡冒出 CaCO3+2HCl==CaCl2+H2O+CO2↑ 没有沉淀(或无明显变化) 小明实验中盐酸过量,所加NaOH太少,无法检验是否有镁(Mg2+、MgCl2)
CaCO3↓+H2O+CO2↑ CaCO3和Mg(OH)2 稀盐酸(或稀HNO3) 固体溶解(消失),有气泡冒出 CaCO3+2HCl==CaCl2+H2O+CO2↑ 没有沉淀(或无明显变化) 小明实验中盐酸过量,所加NaOH太少,无法检验是否有镁(Mg2+、MgCl2)
【解析】水壶内褐色的固体,可能是因为水中含有Ca(HCO3)2和Mg(HCO3)2等可溶性物质在加热时生成了CaCO3和Mg(OH)2。(1)含有较多Ca(HCO3)2的水称硬水,硬水是含有较多钙离子,镁离子的水;加热时发生反应的化学方程式为Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑。
CaCO3↓+H2O+CO2↑。
(2)小明认为该水垢的成分只有CaCO3;但小白不同意,认为也可能只有Mg(OH)2,还可能CaCO3和Mg(OH)2,由质量守恒定律可知。。(3)小明设计如下实验方案:
实验操作 | 现 象 | 结 论 |
①取少量水垢于试管中,加入过量的稀盐酸(或稀HNO3)。 | 观察到现象是固体溶解(消失),有气泡冒出,反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。 | 水垢中有CaCO3 |
②向①反应后的试管中滴加2-3滴NaOH溶液 | 观察到现象是没有沉淀(或无明显变化)。 | 水垢中没有Mg(OH)2,氯化镁与氢氧化钠反应生成氢氧化镁白色沉淀 我的猜想成立 |
(4)小白不认可小明的结论,认为他的实验操作有缺陷,原因是小明实验中盐酸过量,所加NaOH太少,无法检验是否有镁(Mg2+、MgCl2)。
点睛∶水垢主要成分是CaCO3和Mg(OH)2。含有较多钙离子,镁离子的水,称为硬水。碳酸氢盐不稳定,加热易分解。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
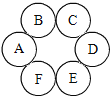
(1)A的固体俗称是_______________;
(2)E与F反应的现象是_________________________________;
(3)C与D反应的化学方程式____________________________________,属于________反应(填基本反应类型)。
(4)除相邻物质之间能发生化学反应外,还能相互反应的化学方程式____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:


(1)上述生产纯碱的方法称____________________,副产品的一种用途为_________________。
(2)向沉淀池中通入两种气体,先通入的是________________(填“NH3”或“CO2”),沉淀池发生的化学反应方程式是_______________________________。
(3)写出上述流程中X物质的化学式_____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____________(填“循环I”或“循环II”)。从沉淀池中取出NaHCO3沉淀的操作是__________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的_______,排除Na2CO3的干扰,再滴加___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图的实验常用仪器回答有关问题。
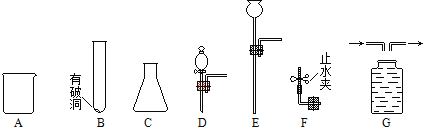
(1)仪器A的名称______________。
(2)若用过氧化氢制备氧气并控制反应速率,应选用上述仪器中的_____(填序号),其化学反应方程式为______。
(3)若用Zn和稀硫酸制备氢气并使反应随时发生或停止,应选仪器_____(填序号),其反应方程式为____。
①用充满水的G收集H2,请将图G补画完整。
②为了获得纯净的硫酸锌晶体,可先加入过量的________或________除去制H2后溶液中过量的酸,过滤,______,降温结晶,得到硫酸锌晶体。
-
科目: 来源: 题型:
查看答案和解析>>【题目】五水合硫酸铜(化学式:CuSO4·5H2O)也被称作硫酸铜晶体,俗称蓝矾或胆矾。具有催吐、祛腐、治风痰壅塞、癫痫、牙疳、口疮、痔疮、肿毒的功效并且有一定的副作用。
(1)五水合硫酸铜中由_______种元素组成,原子个数比:S:O:H=_______________。
(2)五水合硫酸铜中硫酸铜的质量分数___________%;将25g五水合硫酸铜放入100g水中充分搅拌后完全溶解,所得溶液的溶质质量分数为________________%。(结果保留0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如下图所示。(结果保留两位小数)
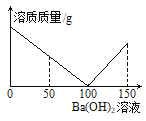
(1)参加反应的Ba(OH)2质量共有 g。当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH 7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数(写出答题过程,结果保留0.01%)。
(3)在下图中画出产生沉淀质量与滴加Ba(OH)2溶液的质量关系。

(4)滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数为 (结果保留0.01%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国科学家研制出一种催化剂,能在室温下高效催化居室空气中的一种有毒气体,其反应过程的微粒示意图如下所示.下列说法正确的是( )
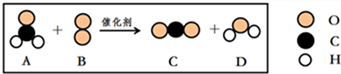
A. 该反应属于置换反应 B. 变化过程中分子个数发生了改变
C. 该反应中A与B的质量比为1:1 D. 该反应中C、D的分子个数比为1:1
相关试题

