【题目】为测定Na2CO3样品是否纯净,某同学称取11.4g样品放入烧杯中,向烧杯中加入73g稀盐酸.恰好完全反应后烧杯中剩余的总质量为80g(假设产生的气体全部逸出)(计算结果精确到0.1%).
(1)反应生成气体的质量为 g.
(2)样品中碳酸钠的质量是多少?
(3)所取稀盐酸中溶质质量分数是多少?
参考答案:
【答案】(1)4.4; (2)样品中碳酸钠的质量是10.6g;
(3)反应后所得溶液中溶质的质量分数15.6%.
【解析】(1)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳逸散到空气中,故烧杯中减少的质量即为生成的二氧化碳的质量。生成的二氧化碳的质量=11.4g+73g-80g=4.4g;(2)利用化学方程式,根据碳酸钠与二氧化碳反应的质量比即可计算出样品中碳酸钠的质量,利用二氧化碳与盐酸反应的质量比即可计算出所取稀盐酸中溶质质量。
设样品中碳酸钠的质量为x;所取稀盐酸中溶质质量为y;
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 73 44
X y 4.4g
![]() x=10.6g
x=10.6g
![]() y=7.3g
y=7.3g
(3)所取稀盐酸中溶质质量分数=![]() 10%
10%
答:反应生成气体的质量为4.4g;样品中碳酸钠的质量是10.6g;所取稀盐酸中溶质质量分数是10%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请你根据所学知识并结合如图所示装置回答下列问题.
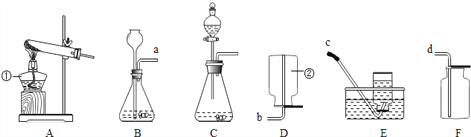
(1)写出图中标有①、②的仪器名称:①___________、②___________.
(2)用高锰酸钾制取氧气的化学方程式为______________________,发生装置应选___________,若收集氧气选择装置F,验满的方法是________________,集满氧气的集气瓶应___________(填“正”或“倒)放在桌面上,停止制气时应进行的操作是___________.
(3)晓华同学用大理石和稀盐酸反应制取二氧化碳气体,他应选择的发生装置是___,收集装置是____,反应的化学方程式是__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在水、铁粉和氦气三种物质中,由原子直接构成的物质是(填化学式) 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在下列空格中填写相应的物质名称或化学式(6分)
物质名称
氢气
氢氧化钙
氖气
化学式
CuO
MgCl2
FeSO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】在水溶液中能大量共存,且溶液为无色透明的一组物质是
A. KCl、BaCl2、NaOH B. Na2CO3、NaCl、Ca(OH)2
C. CuO、NaCl 、H2SO4 D. Ca(OH)2、HCl、Na2SO4
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质所属类别不正确的是
选项
A
B
C
D
物质
蔗糖
金刚石
纯碱
水银
类别
有机物
单质
正盐
化合物
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是三种物质的溶解度曲线,下列说法正确的是 ( )
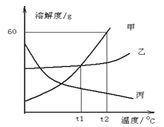
A. 丙物质的饱和溶液升温后,将变成不饱和溶液
B. t1℃时,甲、乙饱和溶液的溶质质量分数相等
C. t2℃时将70g甲物质加入100g水中,可得到170g溶液
D. 将甲、乙饱和溶液从t2℃降到t1℃,析出甲的质量大
相关试题

