【题目】地球上的金属资源广泛地存在于地壳和海洋中。
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
冶炼方法 | 主要原理 | 代表金属 |
电解法 | 熔融的金属化合物在通电的条件下分解 | 钠、铝 |
热还原法 | 金属氧化物与一氧化碳(或碳等)在高温的条件下反应 | 铁、铜 |
热分解法 | 金属氧化物在加热的条件下分解 | 汞、银 |
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:___________、___________。
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:_________________________。
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:_______________________。
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的_______________。
(2)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)____________
参考答案:
【答案】 ![]()
![]() 3CO+ Fe2 O3高温 2Fe + 3CO2 2HgO△2Hg + O2↑ 热还原法 3.04t
3CO+ Fe2 O3高温 2Fe + 3CO2 2HgO△2Hg + O2↑ 热还原法 3.04t
【解析】(1)①根据化学式、元素符号、化合价的书写规则书写;
②③根据反应物、生成物、反应原理解答;
④根据金属的活动性的强弱分析;
(2)根据相关化学方程式计算解答。
解:(1)①氯化镁和镁的化学式,并标出其中镁元素的化合价: ![]()
![]()
②3CO+ Fe2 O3高温 2Fe + 3CO2
③2HgO △ 2Hg + O2↑
④铅的活动性在铁和铜之间,故从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的热还原法;
(2)设:可生产硫酸亚铁的质量为x。
Fe + H2SO4 == Fe SO4 + H2↑
98 152
9.8t×20% x
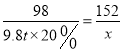
x=3.04t
答:可生产硫酸亚铁的质量为3.04t。
-
科目: 来源: 题型:
查看答案和解析>>【题目】【2015年湖北省宜昌市】空气的成分中,能供给呼吸的是( )
A.氮气 B.氧气 C.二氧化碳 D.水蒸气
-
科目: 来源: 题型:
查看答案和解析>>【题目】按体积算在空气含量最多的是
A、氧气 B、稀有气体 C、氮气 D、二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】科学证明:空气中的微量臭氧(O3),可抵抗阳光中紫外线对人体的损害。制冷剂“氟里昂”是一种氯氟 烃(以M代替其化学式),它可破坏臭氧层,其反应过程可表示为:M + O3 → MO + O2 MO + O3 → M + O2根据所学知识可知氯氟烃在反应中的作用是:
A、催化剂 B、还原剂 C、氧化剂 D、稳定剂
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅(Si)是信息技术的关键材料,以石英砂(主要成分为SiO2)为原料制得纯硅的生产过程如下图所示:

(1)反应①中会排放出CO,CO极易与血液中的_____________结合,从而使其不能再与氧气结合,造成生物体缺氧。
(2)反应②对应的化学方程式为_______________________________________。
(3)反应③所属基本反应类型为_____________;物质A的水溶液可用来除铁锈,发生反应的化学方程式为_______________________________________。
(4)100 t含SiO2 90%的石英砂,理论上可生产纯硅的质量是_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,向盛有一定量石灰石样品(杂质不溶于水、不参与反应)的烧杯中不断加入稀盐酸,其中纵坐标(Y)表示正确的是

A. 水的质量
B. 二氧化碳的质量
C. 样品中碳酸钙的质量
D. 溶液中氯化钙的质量分数
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用高锰酸钾制取氧气时有如下操作步骤:①加热,②检查装置的气密性,③装药品,④用排水集气法收集,⑤从水槽中取出导气管,⑥熄灭酒精灯,⑦连接仪器。其中操作顺序正确的是
A、①⑦③②⑤④⑥ B、⑦②③①④⑤⑥
C、⑤⑦③②①④⑥ D、⑦③①②④⑥⑤
相关试题

