【题目】完成下列实验.(1)现提供下列装置:
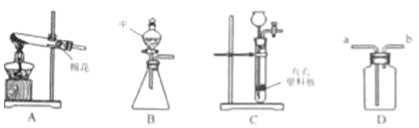
①写出上图中B装置甲仪器的名称 .
②实验室用A装置进行高锰酸钾制氧气的实验,化学方程式为 ,用D装置收集氧气,气体由导管
进入(填“a”或“b”)
③实验室用锌粒和稀盐酸制氢气,用C装置代替B装置的优点是 :若要检验氧气中是否含有氯化氢气体,可将气体通过盛有 溶液的D装置(填“AgNO3”或“饱和NaHCO3溶液”)
(2)对一定质量的粗盐(含泥沙)进行初步提纯.
①实验主要步骤:称量与 、过滤、蒸发;实验中多次使用玻璃棒.过滤时它的作用是 ;蒸发时,待蒸发皿中出现 时停止加热.利用余热将滤液蒸干.
②下列因素会导致获得的精盐质量偏小的是 (填序号)
a.蒸发是液滴溅出 b.过滤时,滤纸破损
c.粗盐中加入过量的水 d.过滤后,滤纸上的泥沙未同水冲洗.
参考答案:
【答案】(1)分液漏斗; 2KMnO4![]() K2MnO+MnO2+O2↑;a;节约药品;AgNO3;(2)溶解;引流;较多量晶体;ad
K2MnO+MnO2+O2↑;a;节约药品;AgNO3;(2)溶解;引流;较多量晶体;ad
【解析】(1)①B装置甲仪器是分液漏斗;②高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的方程式是:2KMnO4![]() K2MnO+MnO2+O2↑;氧气的密度比空气大,所以用装置D收集氧气时,氧气从长管进入;故填:③C装置与B装置比较可知,C装置容器小,节约药品;氯化氢溶于水形成盐酸,盐酸能与硝酸银溶液反应生成氯化银白色沉淀和硝酸,所以通常用硝酸银溶液来检验氢气中是否混有氯化氢气体;(2)①实验主要步骤:称量、溶解、过滤、蒸发;在过滤操作中,玻璃棒的作用是引流;待蒸发皿中出现较多量晶体时停止加热.利用余热将滤液蒸干;②a.蒸发时液滴溅出,造成结晶出的氯化钠质量偏小;b.过滤时,滤纸破损会造成所得氯化钠中混有少量泥沙,导致结晶出的氯化钠质量偏大;c.粗盐中加入过量的水对实验结果没有影响;d.过滤后,滤纸上的泥沙未用水冲洗造成少量氯化钠粘在泥沙上,导致结晶出的氯化钠偏少.故选ad.
K2MnO+MnO2+O2↑;氧气的密度比空气大,所以用装置D收集氧气时,氧气从长管进入;故填:③C装置与B装置比较可知,C装置容器小,节约药品;氯化氢溶于水形成盐酸,盐酸能与硝酸银溶液反应生成氯化银白色沉淀和硝酸,所以通常用硝酸银溶液来检验氢气中是否混有氯化氢气体;(2)①实验主要步骤:称量、溶解、过滤、蒸发;在过滤操作中,玻璃棒的作用是引流;待蒸发皿中出现较多量晶体时停止加热.利用余热将滤液蒸干;②a.蒸发时液滴溅出,造成结晶出的氯化钠质量偏小;b.过滤时,滤纸破损会造成所得氯化钠中混有少量泥沙,导致结晶出的氯化钠质量偏大;c.粗盐中加入过量的水对实验结果没有影响;d.过滤后,滤纸上的泥沙未用水冲洗造成少量氯化钠粘在泥沙上,导致结晶出的氯化钠偏少.故选ad.
-
科目: 来源: 题型:
查看答案和解析>>【题目】 在20℃时,往100克饱和食盐溶液中,加入5克食盐,保持不变的是
A.溶质质量 B.溶剂质量 C.溶液质量 D. 以上皆是
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~H为初中化学常见物质.其中A、E为氧化物且E为常见的液体,B、D为碱,H、G为单质,C为石灰石的主要成分,F为胃酸的主要成分;反应①为光合作用.它们之间的相互关系如图所示.其中“→”表示转化关系,“﹣”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略).
请回答下列问题:
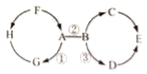
(1)C的化学式为 ;E的化学式为 .
(2)B物质的一种用途为 ;反应③的基本反应类型为 .
(3)写出下列反应的化学方程式:① ;② ;③ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类的生存与发展离不开化学.
(1)2017年5月,我国首架大型客机C919首飞,飞机材料中使用了大量的铝镁合金,它属于 材料,铝制品具有“自我保护”能力,原因是 .
(2)2017年5月,我国载南海进行了天然气水合物(可燃冰)试开采,天然气的主要成分为 (填化学式),其完全燃烧的化学方程式为 .
(3)活性炭净化水,是利用了它的 性,生活中硬水软化的常用方法是 .
(4)硫酸型酸雨的形成与大气污染物中的 气体有关,吸收该气体常用 溶液.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
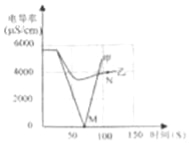
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈 色;
③通过对甲曲线的分析,下列说法错误的是 (填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零 C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是 (填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是 (填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度 (填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式.
示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】亚硝酸钠(NaNO2)是一种工业用盐,它有毒有咸味,外形与食盐相似。人若误食会引起中毒,危害人体健康,甚至致人死亡,在亚硝酸钠中氮元素的化合价是( )
A.-3 B.+3 C.+5 D.0
-
科目: 来源: 题型:
查看答案和解析>>【题目】空气是一种成分复杂的混合物,其中约占空气体积21%的气体是( )
A. N2 B.CO2 C.稀有气体 D.O2
相关试题

