【题目】某化学兴趣小组对胃药“碳酸氢钠片”进行了探究,具体做法如下:
Ⅰ.取1片胃药研碎,加水完全溶解得到100g溶液;
Ⅱ.配制100g 0.365%的稀盐酸作为模拟胃酸;
Ⅲ.取上述一种溶液20g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如图所示.
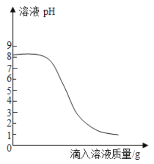
请回答下列问题:
(1)碳酸氢钠属于______(填“酸”“碱”或“盐”);
(2)步骤Ⅲ中,当滴入另一种溶液的质量为10g时,锥形瓶内物质恰好完全反应(胃药中其它成分不参加反应),请根据实验数据计算每片胃药中碳酸氢钠的质量,写出必要的计算过程。
参考答案:
【答案】(1)盐;(2)0.42g。
【解析】
试题分析:(1)碳酸氢钠是由酸根和金属组成的,属于盐;
(2)设20g碳酸氢钠溶液中含有的碳酸氢钠的质量为x,
NaHCO3+HCl=NaCl+H2O+CO2↑
84 36.5
x 10g×0.365%
![]() ,解得:x=0.084g;则每片胃药中碳酸氢钠的质量是0.084g×
,解得:x=0.084g;则每片胃药中碳酸氢钠的质量是0.084g×![]() =0.42g。
=0.42g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是有关质量守恒定律的实验,试回答下列问题:
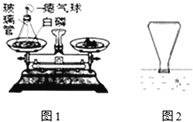
(1)反应过程中观察到锥形瓶内的现象是 ;
(2)在实验前,细沙铺在锥形瓶内的底部,白磷放在细沙上,细沙的作用是 ;
(3)该实验告诉我们:用实验研究化学反应前后反应物与生成物之间的质量关系时,必须在 体系中进行.
(4)实验结束后(锥形瓶已冷却到室温),发现瓶中白磷过量,为了防止白磷在空气中燃烧,将锥形瓶瓶口倒置于盛满水的水槽中(如图2,瓶口贴紧水面),拔下瓶塞,发现水进入锥形瓶中,则进入瓶中的水占锥形瓶的容积的 ,原因是: .
(5)写出白磷在空气中燃烧的反应的化学方程式 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取气体常常用到下列装置,根据给出的装置回答下列问题:
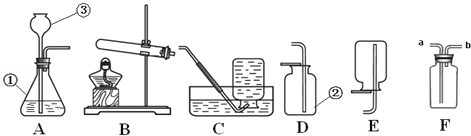
(1)写出图中标号仪器的名称:① ;② ;③ .
(2)若该实验选择装置A来制取氧气,请写出该反应的化学方程式 .
(3)若选择高锰酸钾制取并收集较纯净的O2,则应选择装置 .该套装置有一处不足的地方,请你指出并加以改进: .
(4)用图F装置可以收集和干燥氧气:若广口瓶充满水来收集氧气,气体应从 (填“a”或“b”)端通入.
(5)实验室常用块状固体硫化亚铁( FeS)和稀硫酸在常温下制取硫化氢气体,有关化学方程式为:FeS+H2SO4═H2S↑+FeSO4,硫化氢气体是一种有臭鸡蛋气味的有毒的气体,能溶于水,密度比空气大.根据上述信息回答:实验室制取硫化氢的发生装置为 (用序号填空,下同),收集装置为 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于化学性质的是
A.挥发性 B.溶解性 C.稳定性 D.导电性
-
科目: 来源: 题型:
查看答案和解析>>【题目】用符号表示下列意义或写出符号的意义:
5个铁原子 3个二氧化硫分子
铝元素的化合价为+3价 4Cu2+ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】鉴别下列各物质的方法,正确的是
需鉴别的物质
方法
A
吸入的气体和呼出的气体
观察颜色
B
氧气和空气
闻气味
C
铁粉和炭粉
用磁铁
D
矿泉水和蒸馏水
过滤后,观察是否有杂质残留在滤纸上
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】将黑色粉末A和无色液体B混合,生成一种无色无味的气体C;加热暗紫色固体E,可同时得到A和C;无色气体C能使带火星的木条复燃.若将银白色金属D放在盛有C的集气瓶中燃烧,火星四射,生成一种黑色固体F,并放出热量.试推断A、B、C、D、E、F各是什么物质?
A ,B ,C ,D ,E ,F .
(1)写出加热E所发生的化学方程式(或文字表达式): .
(2)写出D在C中燃烧的化学方程式(或文字表达式): .
相关试题

